I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
La fondamentale importanza delle proteine non è in discussione, attraverso queste molecole le cellule svolgono tutte le proprie funzioni. Le proteine sono molecole di grandi dimensioni e di elevato peso molecolare, la struttura è però molto simile sono venti aminoacidi che combinandosi in maniera differente modificano il significato della molecola. Le proteine svolgono numerose funzioni ad esempio enzimi che svolgono funzioni non importanti ma fondamentali per la vita e l’equilibrio della cellula stessa. Gli enzimi sono catalizzatori biologici, ovvero facilitano le reazioni abbassando l’energia di attivazione e aumentando la velocità di reazione. Le proteine sono dei mediatori chimici, ovvero modulano i segnali che le cellule si trasmettono, gli anticorpi che regolano la reazione dell’organismo quando entrano sostanze estranee, le proteine formano la struttura degli organi, della membrana cellulare, sono dei mezzi di trasporto di molecole all’interno e all’esterno della cellula. Molte proteine svolgono un azione contrattile e quindi favoriscono il movimento degli organismi inferiori. Costituiscono materiali di deposito servono a nutrire gli embrioni animali e vegetali, ormoni svolgono un azione importante per l’organismo tipo la regolazione del glucosio.
Sono in numero di 20 tutti possiedono l gruppo amminico e acido. Si suddividono in aminoacidi non polari, polari, acidi e basici. Si suddividono ancora in aminoacidi essenziali e non essenziali. Gli aminoacidi presenti nelle proteine appartengono alla serie L infatti molti aminoacidi presentano l’ atomo di carbonio alfa asimmetrico, si parla della isomeria ottica e di tutto quello che si è detto per gli zuccheri. Le due forme speculari vengono indicate come isomero D e L . Vi sono anche aminoacidi diversi ovvero la 6 N metillisina, la 4 idrossiprolina, la 5 idrossilisina.
La presenza di gruppi acidi e basici contemporaneamente nella molecola causa fenomeni particolari, possono polarizzarsi entrambi i gruppi oppure solo uno dei due. Il grado di ionizzazione dipende dal pH e possono essere dipoli oppure no. Il valore di pH dove si forma il dipolo viene chiamato pI punto isoelettrico. I gruppi funzionali sono deboli il calcolo del pI è dato dalla somma dei due valori di pK diviso per due.
PI = pK1 + pK2 / 2
Il grado di ionizzazione dei gruppi acidi e basici è legato al pH della soluzione con la seguente formula:
pH = pKa + log conc base coniugata/ conc acido coniugato
Le reazioni riguardano i gruppi acidi e basici. Si possono avere le seguenti reazioni:
|
|
|
|
|
|
|
|
|
|
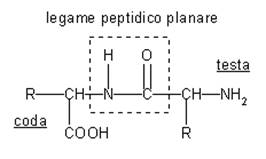
Una delle importanti caratteristiche degli aminoacidi è la reazione tra il gruppo acido e amminico di due differenti aminoacidi, per formare il legame ammidico. Questo dimero che si viene a formare si chiama dipeptide. Il gruppo amminico ed il gruppo carbossilico sono i due terminali. La nomenclatura dei dipeptidi è quella di mettere il nome del primo aminoacido seguito dal nome del secondo aminoacido esempio valilvalina oppure cisteilcisteina. Dal modello spaziale di questi composti si può notare che il legame peptidico è una struttura planare, gli snodi ruotano liberamente intorno ai carboni ibridati sp3. Vengono così a crearsi delle strutture tridimensionali dove i piano vengono ad essere traslati rispetto al legame.
 |
|
Tutti gli aminoacidi abbiamo detto hanno il gruppo acido e basico che sono deboli ovvero poco dissociati. Questi gruppi concorrono alla formazioni di gruppi ionizzati dove una volta è presente la carica positiva altre volte la carica negativa. Vi è un valore di pH dove sono presenti entrambi le cariche quel valore viene detto punto isoelettrico. La ionizzazione degli aminoacidi dipende dal valore del pH, su questa caratteristica sono basate le analisi di separazione degli aminoacidi.
Le proteine sono dei polimeri naturali, formati dalle unità elementari che sono gli aminoacidi, legati con legami peptidici. La proteina viene ad assumere una struttura tridimensionale che è una sua caratteristica, non solo estetica ma bensì funzionale. Una temperatura troppo elevata, un pH troppo alto, la presenza di sali può determinare nella proteina una perdita della struttura tridimensionale. Il processo a cui va incontro la proteina si chiama di denaturazione. Molte volte questo processo è irreversibile, ma per taluni polimeri questo processo è reversibile. La reazione inversa si chiama di rinaturazione. Quando si lavora con una molecola proteica si deve lavorare sempre lontano dalle condizioni di denaturazione perché la molecola perde le sue proprietà.
Le proteine presentano quattro gradi di struttura.
I legami che intervengono nelle strutture delle proteine sono di natura:
Classificazione delle proteine:
Differenti esperienze si possono eseguire in laboratorio sulle proteine.
Analisi delle proteine presenti negli alimenti:
Prendere una piccola porzione di alimento omogeneizzare con un poco di acqua, se la soluzione è torbida filtrare quindi aggiungere qualche goccia dei reattivi scaldando su bagnomaria per qualche minuto. In presenza di proteine avviene una colorazione che varia dal viola all’azzurro, in funzione della provenienza delle proteine animale, vegetale. Il reattivo è formato dalla soluzione A del reattivo di Fehling allo 0,5% e idrossido di sodio al 2%.
Separazione degli aminoacidi e delle proteine con elettroforesi:
Si possono utilizzare come fonte proteica il bianco d’uovo, oppure vegetali, oppure animali, disgregare le proteine in ambiente basico con una concentrazione 5 N, per un tempo di 5 - 6 ore, neutralizzare con acido cloridrico, aggiungere al preparato carbone vegetale, filtrare e concentrare sino a 50 ml. La soluzione che si ottiene contiene aminoacidi derivati dalle proteine. Si prepara lo strumento per l’ elettroforesi, le soluzioni tampone a pH =6,1 e pH = 8,5, si preparano le strisce di carta da filtro, quindi si depongono una serie di aminoacidi di riferimento e si procede all’elettroforesi con 350 V per circa 1 ora. Alla fine della corsa si asciugano i fogli di carta in stufa a 100°C, quindi si spruzzano le lastrine con ninidrina il tutto in stufa a 100°C per asciugare le lastrine. Si formano delle macchie di colore marrone, si calcolano gli Rf, una seconda analisi mette invece le proteine che sono state idrolizzate, stessa corsa si calcolano gli Rf e si confrontano con gli aminoacidi noti; si passa quindi alla valutazione quantitativa del tipo di aminoacidi presenti nella proteina.
Si possono separare una miscela di aminoacidi utilizzando la cromatografia su carta. Si preparano le strisce di carta specifica per la cromatografia, si procede alla semina degli aminoacidi di riferimento, si prepara la miscela eluente formata da alcol butilico, acido acetico glaciale, acqua in rapporto 6:2:3. Si esegue la corsa, alla fine si mette la strisca in stufa ad asciugare, si spruzza una soluzione di ninidrina, il tutto in stufa ad asciugare e si calcolano gli Rf degli aminoacidi noti. Si passa alla semina delle proteine dissociate ad esempio quelle dell’analisi precedente, si calcolano gli Rf e si confrontano con gli aminoacidi noti. Si calcola la quantità di aminoacidi presente nella proteina naturale.
Stessa procedura della precedente ma si utilizza la TLC. La miscela eluente è formata da alcol butilico, acido acetico glaciale e acqua in rapporto 4:1:1, il reattivo è una soluzione di ninidrina.
Da queste tre metodiche si possono trarre le seguenti considerazioni: che differenza esiste tra le metodiche eseguite, quale sensibilità hanno i tre metodi di analisi, quale è il tempo di analisi. Cercare quindi di capire quando utilizzare una metodica rispetto ad un'altra.
Utilizzando l’uovo è possibile fare la cromatografia dei fosfolipidi dal rosso. Utilizzare una lastrina attivata deporre i campioni precedentemente trattati; la soluzione eluente è formata da cloroformio, metanolo, acido acetico acqua in rapporto 80: 10: 6: 4. La lastrina alla fine della corsa viene irradiata con radiazione UV per visualizzare le macchie. La miscela per lo sviluppo è formata da 20 g di solfato di ammonio al 20% , 100 ml di acqua e 3 ml di acido solforico concentrato. Il tutto in stufa a 200°C per circa 30 minuti. Si formano macchie di colore marrone scuro. Si calcolano gli Rf che sono riassunti nella tabella sotto riportata:
Molecole |
R f |
Lecitine |
0,4 |
Fosfatidiletanolammine |
0,9 |
Sfingomieline |
0,2 |
Altre analisi utilizzando campioni come la caseina del latte. Tutte queste analisi debbono fornire agli allievi notizie utili sulla manipolazione delle proteine, potendo verificare le possibilità tecniche per descrivere tutta una serie di proprietà di molecole naturali. Oltre allo studio teorico si passa all’applicazione pratica, utilizzando e rielaborando le informazione assunte a lezione.
Precipitazione della caseina del latte.
Si preleva circa 50 ml di latte aggiunti a 50 ml di acqua distillata. Si scalda a 50°C si aggiungono circa 5 ml di acido acetico al 10%, agitando. Dopo circa 10 minuti si aggiungono 5 ml di acetato di sodio M e si porta la soluzione al
pH = 4,5. Si raffredda e si filtra lavando il bicchiere con acqua fredda. Il precipitato si sospende in etanolo 10 ml si filtra nuovamente e si spreme il precipitato. Si lascia asciugare il precipitato e quindi si passa all’idrolisi della proteine con i metodi sopra descritti. Quindi la procedura da seguire è sempre la stessa. Si potrà variare la miscela eluente e vedere i risultati ottenuti.
Fonte: http://www.itisvc.it/lezionionline/leziochimica/lezioni/aminoprot.doc
Sito web da visitare: http://www.itisvc.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve