I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Una classificazione generale dei composti organici si fonda sulla natura degli atomi che li costituiscono, suddividendoli in Idrocarburi ed Eterocomposti
Gli Idrocarburi sono composti organici contenenti solo Carbonio (C) e Idrogeno (H)· Gli Eterocomposti contengono anche altri atomi (eteroatomi) oltre a C e H, in particolare Ossigeno (O), Azoto (N), Zolfo (S) e Fosforo (P).
Una ulteriore classificazione si fonda sulla forma della molecola, suddividendo i composti organici in aciclici e ciclici. Si definiscono aciclici i composti organici a catena aperta di atomi di carbonio, lineare o ramificata. Si definiscono ciclici i composti organici a catena chiusa in uno o più anelli (monociclici e policiclici).
Un’ultima classificazione suddivide i composti organici in alifatici ed aromatici. Si definiscono aromatici i composti organici ciclici che presentano almeno un anello di tipo benzenico, con più doppi legami che costituiscono una nuvola di elettroni p delocalizzata sull’intero anello. Si definiscono alifatici i composti organici ciclici ed aciclici non aromatici (il termine ‘alifatico’ si riferisce propriamente solo agli idrocarburi non aromatici).
In modo più analitico i composti organici possono essere classificati in famiglie o classi sulla base del gruppo funzionale che li caratterizza.
In chimica organica un gruppo funzionale è un atomo o un raggruppamento di atomi che, per la loro natura ed il tipo di legame che li unisce, conferisce a una molecola le sue caratteristiche chimiche e fisiche, in modo relativamente indipendente dalla struttura molecolare complessiva. In altre parole, un gruppo funzionale è la porzione più reattiva di una molecola organica, che influisce in modo determinante sul meccanismo delle reazioni a cui essa è suscettibile. Per queste ragioni, i composti organici vengono suddivisi nelle varie classi in base alla presenza di uno stesso gruppo funzionale. Così, per es., gli alcoli sono identificati per la presenza di uno o più gruppi ossidrile -OH, le ammine per il gruppo amminico -NH2 etc.
I nomi dei composti di ciascuna famiglia sono caratterizzati da un suffisso (o desinenza) associato in modo univoco al gruppo funzionale che caratterizza la famiglia. In generale la nomenclatura IUPAC per i composti organici viene derivata dal nome dell’idrocarburo corrispondente.
I primi quattro termini degli idrocarburi hanno nomi convenzionali, mentre i termini successivi vengono designati mediante un prefisso (o radice) che indica il numero di atomi di carbonio, seguito dalla desinenza caratteristica della famiglia di idrocarburi
n atomi |
radice |
n atomi |
radice |
|
|
|
|
n |
alc- |
31 |
hentriacont- |
1 |
met- |
32 |
dotriacont- |
2 |
et- |
40 |
tetracont- |
3 |
prop- |
50 |
pentacont- |
4 |
but- |
60 |
esacont- |
5 |
pent- |
70 |
eptacont- |
6 |
es- |
80 |
octacont- |
7 |
ept- |
90 |
nonacont- |
8 |
oct- |
100 |
ect- |
9 |
non- |
200 |
dict- |
10 |
dec- |
300 |
trict- |
11 |
undec- |
400 |
tetract- |
12 |
dodec- |
500 |
pentact- |
13 |
tridec- |
600 |
esact- |
14 |
tetradec- |
700 |
eptact- |
15 |
pentadec- |
800 |
octact- |
16 |
esadec- |
900 |
nonact- |
17 |
eptadec- |
1000 |
kili- |
18 |
octadec- |
2000 |
dili- |
19 |
nonadec- |
3000 |
trili- |
20 |
icos- |
4000 |
tetrali- |
21 |
henicos- |
5000 |
pentali- |
22 |
docos- |
6000 |
esali- |
23 |
tricos- |
7000 |
eptali- |
24 |
tetracos- |
8000 |
octali- |
25 |
pentacos- |
9000 |
nonali- |
26 |
esacos- |
|
|
27 |
eptacos- |
|
|
28 |
octacos- |
|
|
29 |
nonacos- |
|
|
30 |
triacont- |
|
Il prefisso per l’idrocarburo con 486 atomi di carbonio sarà esaoctacontatetract-
esa octaconta tetracta
6 80 400
Idrocarburi alifatici aciclici saturi: Alcani
Gli alcani, caratterizzati da legami semplici C-C (saturazione), presentano desinenza –ano. I loro nomi, ricavati unendo radice+desinenza, saranno pertanto metano, etano, propano,butano pentano etc.
metano CH4
etano CH3-CH3
propano CH3-CH2-CH3
butano CH3-CH2-CH2-CH3
pentano CH3-CH2-CH2-CH2-CH3
etc
I residui che si formano togliendo un idrogeno, conservano la stessa radice, ma cambiano la desinenza da –ano in –ile e saranno pertanto metile, etile, propile, butile, pentile etc
alchile R- (generico)
metile CH3-
etile CH3-CH2-
propile CH3-CH2-CH2-
butile CH3-CH2-CH2-CH2-
pentile CH3-CH2-CH2-CH2-CH2-
etc
I nomi dei residui si usano quando si presentano catene ramificate. L’alcano prende il nome dalla catena lineare più lunga, preceduto dai nomi dei residui che costituiscono le catene laterali (a loro volta preceduti dal numero d’ordine dell’atomo di carbonio della catena principale al quale il residuo è legato)
La catena principale deve essere numerata in modo da dare il numero più basso possibile alle catene laterali. I residui vanno elencati in ordine alfabetico
Le ramificazioni presenti nelle catene laterali vanno indicate ricorrendo all’uso di parentesi
Se due catene diverse occupano posizioni equivalenti bisogna numerare con il numero più basso quella che precede in ordine alfabetico
Gli alcani ramificati più piccoli hanno nomi d’uso
Idrocarburi alifatici aciclici insaturi: Alcheni e Alchini
Gli alcheni, caratterizzati da uno o più legami doppi (C=C), presentano desinenza –ene. I loro nomi, ricavati unendo radice+desinenza, saranno pertanto etene, propene, butene pentene etc.
La posizione del doppio legame viene indicata, numerando gli atomi di carbonio in modo che il doppio legame presenti il numero più basso possibile
etene CH2=CH2
propene CH3-CH=CH2
1-butene CH2=CH-CH2-CH3
2-butene CH3-CH=CH-CH3
1-pentene CH3-CH2-CH2-CH=CH2
etc
Per l’etene è ancora in uso la vecchia nomenclatura: etilene.
I residui che si formano togliendo un idrogeno agli alcheni, conservano la stessa radice, ma cambiano la desinenza da –ene in –enile e saranno pertanto, etenile, propenile, butenile, pentenile etc
etenile CH2=CH-
1-propenile CH3-CH=CH-
2-propenile CH2=CH-CH2-
1-butenile CH3-CH2-CH=CH-
2-butenile CH3-CH=CH-CH2-
3-butenile CH2=CH-CH2-CH2-
etc
Per l’etenile ed il 2-propenile è ancora in uso la vecchia nomenclatura: vinile e allile.
Se sono presenti due o più doppi legami la desinenza diventa –andiene, -antriene, -antetraene etc. Gli alcheni con due doppi legami sono noti come dieni. I dieni con i doppi legami cumulati (-C=C=C-) sono noti come alleni.
propandiene CH2=C=CH2
1,2-butandiene CH2=C=CH-CH3
1,3-butandiene CH2=CH-CH=CH2
butantriene CH2=C=C=CH2
pentantetraene CH2=C=C=C=CH2
etc
Per il propandiene è ancora in uso la vecchia nomenclatura: allene.
Gli alchini, caratterizzati da uno o più legami tripli (C≡C), presentano desinenza –ino. I loro nomi, ricavati unendo radice+desinenza, saranno pertanto etino, propino, butino pentino etc.
La posizione del triplo legame viene indicata, numerando gli atomi di carbonio in modo che il triplo legame presenti il numero più basso possibile
etino CH≡CH
propino CH3-C≡CH
1-butino CH≡C-CH2-CH3
2-butino CH3-C≡C-CH3
1-pentino CH3-CH2-CH2-C≡CH
etc
Per l’etino è ancora in uso la vecchia nomenclatura: acetilene.
I residui che si formano togliendo un idrogeno agli alchini, conservano la stessa radice, ma cambiano la desinenza da –ino in –inile e saranno pertanto, etinile, propinile, butinile, pentinile etc
etinile CH≡C-
1-propinile CH3-C≡C-
2-propinile CH≡C-CH2-
1-butinile CH3-CH2-C≡C-
2-butinile CH3-C≡C-CH2-
3-butinile CH≡C-CH2-CH2-
etc
Idrocarburi alifatici ciclici (aliciclici) saturi e insaturi: Cicloalcani e cicloalcheni
I cicloalcani ed i cicloalcheni prendono il nome dal composto lineare corrispondente preceduto dal prefisso ciclo-. In modo del tutto analogo agli idrocarburi aciclici, anche i loro residui prendono la desinenza –ile.
Idrocarburi aromatici (areni) monociclici e policiclici
La nomenclatura IUPAC ha accettato i nomi d’uso
benzene |
toluene |
stirene |
cumene |
|
|
|
|
Da evitare i termini benzolo, toluolo e stirolo, non ammessi dalla IUPAC.
Il residuo del benzene è detto fenile.
Il residuo del toluene che perde un idrogeno dell’anello è detto tolile.
Il residuo del toluene che perde un idrogeno del metile è detto benzile.
naftalene |
antracene |
fenantrene |
indene |
|
|
|
|
Ai sistemi policiclici condensati linearmente si assegna un nome sistematico formato da un prefisso numerico seguito dalla desinenza –acene.
tetracene |
pentacene |
|
|
Come abbiamo già detto i composti organici possono essere classificati in famiglie o classi sulla base del gruppo funzionale che li caratterizza e la loro nomenclatura viene derivata da quella dell’idrocarburo corrispondente (della quale abbiamo appena trattato)
I nomi dei composti di ciascuna famiglia possono essere definiti usando due metodi alternativi:
1. metodo di nomenclatura sostitutiva
2. metodo radico-funzionale
Il metodo di nomenclatura sostitutiva, essendo più generale, è consigliato dalla IUPAC e permette di definire nomi di composti organici molto complessi contenenti più di un gruppo funzionale. Ogni gruppo funzionale viene considerato un sostituente, la cui presenza viene indicata utilizzando opportuni suffissi e prefissi.
Il metodo radico-funzionale si usa in genere per molecole semplici che presentano un unico gruppo funzionale. Il nome del composto viene generato sommando una radice (presa dall’idrocarburo corrispondente) ed un desinenza (o un suffisso) associato in modo univoco al gruppo funzionale che caratterizza la famiglia.
| Famiglia |
Struttura |
Gruppo funzionale |
Desinenza (suffisso)
|
Prefisso |
nome radico-funzionale Esempio nome sostitutivo |
|---|---|---|---|---|---|
Alcani |
|
legame semplice |
-ano |
|
|
Alcheni |
|
alchenilico (legame doppio) |
-ene |
en- |
|
Alchini |
|
alchinico (legame triplo) |
-ino |
in- |
|
Radicali
|
R• |
elettrone spaiato
|
-ile |
- |
|
Anioni (perdita H+ da idruri) |
R- |
carica negativa
|
-uro |
- |
|
Anioni (perdita H+ da calcogeni) |
R- |
carica negativa
|
-ato
|
- |
|
Cationi (perdita H-) |
R+ |
carica positiva
|
-ilio |
- |
|
Cationi (acquisto H+) |
R+ |
carica positiva
|
-io |
- |
|
Alcoli
|
R-OH |
ossidrile -OH |
-olo |
idrossi- |
|
Enoli
|
|
>C=C<OH |
-enolo |
idrossi- ol- |
|
Idroperossidi
|
R-O-OH |
idroperossido -O-OH |
- |
idroperossi- |
|
Perossidi
|
R-O-OR’ |
perossido -O-O- |
- |
(alchil)perossi- (alchil)diossi- |
|
Fenoli |
Ar-OH (Ph-OH) |
ossidrile -OH |
-olo |
idrossi- |
|
Acidi carbossilici |
|
carbossile -COOH |
acido -oico (-carbossilico)
|
carbossi- (**)
|
|
Anidridi |
|
-CO-O-CO- |
anidride –oica
anidride (alchil) -carbossilica
|
(alc)ossi- osso- (*) |
|
Perossiacidi (Peracidi) |
|
idroperossicarbonile -CO-O-OH |
acido perossi- -oico
|
idroperossicarbonil- (**)
|
|
Aldeidi |
|
carbonile
|
-ale (-aldeide) (-carbaldeide) |
osso- (formil-)
|
|
Chetoni |
|
carbonile
|
-one (-chetone) |
osso- (cheto-)
|
|
Esteri |
|
estereo R-COO- |
-oato di alchile |
(alc)ossi- osso- (*) (alc)ossicarbonil- carbossi(alchil)- (**)
|
|
Lattoni (Esteri ciclici) |
|
estereo R-COO- |
-lattone |
ossi- osso- (*) |
|
Eteri |
R―O―R’ |
etereo R-O- |
etere -ilico
|
(alc)ossi- |
|
Alogenuri alchilici
|
R-X X=Br,Cl,F |
alogeno (-Br,Cl,F) |
Alogenuro -ilico |
alogeno- |
|
Alogenuri arilici
|
Ar-X X=Br,Cl,F |
alogeno (-Br,Cl,F) |
- |
alogeno- |
|
Alogenuri acilici |
|
alocarbonile
|
Alogenuro di -anoile |
alogenoformil- alogenocarbonil- (**) (osso- alogeno-) (*) |
|
Tioli (Tioalcoli o Mercaptani) |
R-SH |
solfidrile -SH |
-tiolo
|
mercapto- (solfanil-) |
|
acidi solfonici |
R-SO3H |
solfonico -SO3H |
acido -solfonico |
solfo- |
|
acidi solfinici |
R-SO2H |
solfinico -SO2H |
acido -solfinico |
solfino- |
|
acidi solfenici |
R-SOH |
solfenico -SOH |
acido -solfenico |
solfeno- |
|
O-Tioacidi |
|
O-tioato -CS-OH |
acido O -tioico |
idrossi- tiosso- (*) |
|
S-Tioacidi |
|
S-tioato -CO-SH |
acido S -tioico |
mercapto- osso- (*) mercaptoformil- mercaptocarbonil- (**) |
|
Ditioacidi |
|
ditioato -CS-SH |
acido -ditioico |
mercapto- tiosso- (*) |
|
Tioeteri (Solfuri) |
R―S―R’ |
solfuro R-S- |
solfuro –ilico (alchil)-solfano |
(alchil)tio- (alchil)solfanil-
|
|
Disolfuri |
R―S―S―R’ |
disolfuro -S-S- |
disolfuro -ilico |
(alchil)ditio- |
|
Tiochetoni |
|
tionico
|
-tione |
tiosso- |
|
Tioaldeidi |
|
tionico
|
-tiale |
tiosso- |
|
Ammine |
R―NH2
primarie
|
amminico -NH2 >NH >N- |
(alchil) -ammina |
ammino- |
|
secondarie |
|||||
terziarie |
|||||
Enammine |
|
>C=C<N< |
alchen -ammina |
ammino- en- |
|
Inammine |
|
-C≡C-N< |
alchin -ammina |
ammino- in- |
|
Immine |
|
imminico >C=NH |
-immina |
immino- |
|
Ammidi |
|
ammidico -CONH2 |
-ammide |
carbamoil (**) osso- ammino- (*) |
|
Lattami (Ammidi cicliche) |
|
ammidico -CONH- |
-lattame |
osso- ammino- (*) |
|
Immidi |
|
immidico -CO-NH-CO- |
-immide |
Osso- ammino- (*)
|
|
Nitrili |
R―C≡N |
nitrile -CN |
-nitrile |
ciano- (**) |
|
Nitrocomposti |
R―NO2 |
nitrico ―NO2 |
- |
nitro-
|
|
Nitrosocomposti |
R―NO |
nitroso ―NO |
- |
nitroso-
|
|
Azidi |
R―N3 |
azido ―N=N≡N |
-azide |
azido-
|
|
Azocomposti |
Ar―N2― Ar’ |
azoico ―N=N― |
- |
azo-
|
|
Diazocomposti |
R-N2 |
diazoico -N≡N |
- |
diazo-
|
|
Ammidine |
|
ammidinico HN=C<NH2 |
-ammidine |
ammino- immino- (ammidino-)
|
|
Ossime |
|
ossimico >C=N-OH |
-ossima |
idrossiimmino- |
|
Idrazine |
R―NH-NH2 |
idrazinico ―NH-NH2 |
-idrazina |
idrazinil- |
|
Idrazoni |
|
idrazonico >C=N-NH2 |
(alcanal)-idrazone |
idrazono- |
|
Idrazidi |
|
idrazidico ―CO-NH-NH2 |
-idrazide |
idrazinil- osso-
|
** I prefissi includono il carbonio del gruppo funzionale nel nome. Pertanto quando si contano gli atomi di carbonio della catena principale non si deve contare l’atomo di carbonio di questo gruppo funzionale!
* Nel prefisso i due gruppi sono considerati distinti e separati
Quando in una molecola sono presenti più gruppi funzionali è necessario usare il metodo di nomenclatura sostitutiva, utilizzando l’ordine di priorità dei diversi gruppi. Se in un composto organico si presentano più gruppi funzionali, si usa il suffisso (desinenza) per il gruppo a maggior priorità (numero di priorità più basso), il quale definisce anche la lunghezza della catena principale, mentre tutti gli altri vengono indicati usando il prefisso. La precedenza va assegnata ai diversi gruppi secondo la seguente scala di priorità decrescente
Per una scala di priorità più dettagliata si consulti la tabella successiva
Gruppi funzionali – Priorità decrescente
La catena principale si individua applicando i seguenti criteri. Si passa all’applicazione del criterio successivo, solo se nella molecola vi sono più catene (o nessuna) che soddisfano il criterio precedente.
A) Molecole senza gruppi funzionali (idrocarburi)
B) Molecole con gruppi funzionali
Una volta individuata la catena principale, i suoi atomi vengono dunque numerati in modo da assegnare la numerazione più bassa
Se nella molecola è presente un gruppo prioritario questo definisce il suffisso (desinenza). Gli altri sostituenti verranno indicati tramite i loro prefissi in ordine alfabetico. Ciascun sostituente verrà preceduto dal numero dell’atomo della catena principale al quale è connesso. Se vi sono più sostituenti dello stesso tipo si usano i prefissi moltiplicativi (di- tri- tetra- etc) i quali non influenzano l’ordine alfabetico.
I numeri vengono separati da virgole.
i prefissi vengono separati da trattini
Numeri e prefissi vengono separati da trattini.
In generale la numerazione della catena principale viene fatta in modo che catene laterali e sostituenti presentino una combinazione di numeri la più bassa possibile. La più bassa combinazione di numeri è definita come quella combinazione che, confrontato cifra a cifra con un’altra in ordine crescente di valori, presenta la cifra più bassa al primo punto di differenza. Ad esempio la combinazione 2,3,5,8 è più bassa delle combinazioni 3,4,4,6 (nella prima cifra), 2,3,6,7 (nella terza cifra) e 2,4,5,7 (nella seconda cifra).
Esempio 1
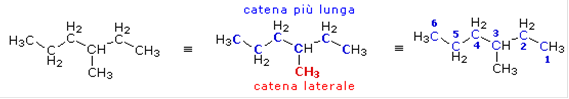
Per la catena principale, che ha 6 atomi di carbonio, si userà la radice es-. Non essendovi nessun gruppo funzionale, ed essendo il composto saturo, la desinenza sarà –ano. La catena principale è numerata in modo che la catena laterale metilica assuma la numerazione più bassa. Il composto sarà pertanto 3-metil-esano.
Esempio 2
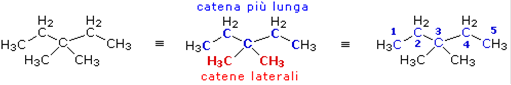
La catena principale presenta 5 atomi (pentano) con due gruppi metilici in posizione 3. Il composto è dunque 3,3-dimetil-pentano
Esempio 3
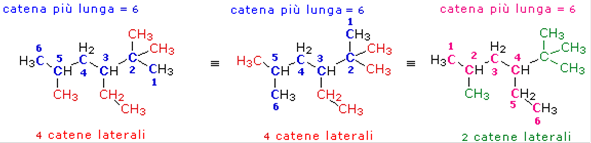
Sono possibili più catene a maggior lunghezza (6 atomi). Le due a sinistra (colorate in blu) sono equivalenti. Presentano infatti lo stesso numero di catene laterali e la stessa numerazione delle stesse. La catena blu presenta 4 catene laterali, rispetto alle 2 catene laterali della catena magenta e deve pertanto essere preferita. La catena principale va inoltre numerata da destra verso sinistra e non viceversa. I gruppi metilici in posizione simmetrica (2 e 5) ed equidistante dalle due estremità della catena principale sono indifferenti al verso della numerazione, ma il gruppo etilico prende in tal modo la numerazione più bassa (3 e non 4). Il composto è dunque 3-etil-2,2,5-trimetil-esano
Esempio 4
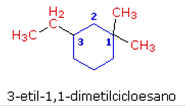
Per mantenere la numerazione più bassa possibile gli atomi del cicloesano vanno numerati a partire dal carbonio legato ai due gruppi metilici (che diventano 1,1) ed in senso antiorario verso il gruppo etilico.
Si noti che:
Esempio 5
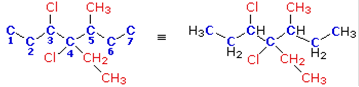
La catena blu a 7 atomi (eptano) è la più lunga catena contenente i due sostituenti non prioritari (atomi di cloro). Va numerata da sinistra a destra in modo che il primo atomo di cloro presenti il numero più basso possibile. Il composto è dunque 3,4-dicloro-4-etil-5-metileptano (si notino i prefissi in ordine alfabetico).
Esempio 6

1,1,4,4-tetracloro-2-isopropilciclopentano
Per mantenere la numerazione più bassa possibile gli atomi del ciclopentano vanno numerati a partire dal carbonio legato ai due atomi di cloro in alto (che diventano 1,1) ed in senso antiorario verso il gruppo isopropilico (che diventa 2).
Esempio 7
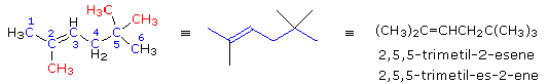
La catena principale è la più lunga catena che contiene il doppio legame, numerata in modo che il primo atomo di carbonio impegnato nel doppio legame presenti il numero più basso possibile. La desinenza –ene indica la presenza del doppio legame
Esempio 8

La catena principale è la più lunga catena che contiene il doppio legame, numerata in modo che il primo atomo di carbonio impegnato nel doppio legame presenti il numero più basso possibile. In questo caso il doppio legame prenderebbe il numero 3 indipendentemente dal verso della numerazione. Si numera da destra verso sinistra perché in questo modo la prima catena laterale prende il numero più basso (numerando da sinistra verso destra avremmo avuto 3-etil-5-metil-3-esene)
Esempio 9
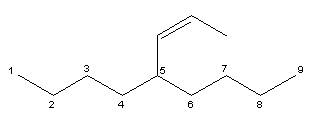
5-(prop-1-enil)-nonano
La catena principale è la catena più lunga. Il verso della numerazione è indifferente poiché la catena laterale è equidistante dalle due estremità.
Esempio 10

3-etinil-otta-1,5-diene
La catena principale può essere scelta tra due catene alternative a 8 atomi, entrambe contenenti 2 insaturazioni. Si sceglie quella che contiene il maggior numero di legami doppi e la si numera da destra a sinistra in modo che i legami doppi presentino numeri identificativi più bassi possibile.
Esempio 11
A
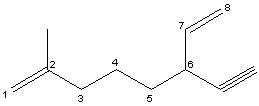
6-etinil-2-metil-otta-1,7-diene
B)
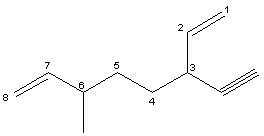
3-etinil-6-metil-otta-1,7-diene
B) Rispetto alla molecola precedente le due catene laterali si trovano in posizione equivalente e risultano pertanto indifferenti al verso della numerazione della catena principale. (prenderebbero comunque la numerazione 3,6). In questo caso si numera da destra a sinistra in modo che la catena che precede in ordine alfabetico (etilica) prenda il numero più basso.
C)

6-etinil-3,4-dimetil-otta-1,7-diene
C) In questo caso non si applica il criterio della precedenza alfabetica per le catene laterali in posizione equivalente (3,6) poiché esiste un’altra catena che risulta essere più vicina all’estremità di sinistra della catena principale. Si numera dunque la catena principale da sinistra a destra in modo che la seconda catena metilica presenti il numero più basso (4 e non 5)
D)

3-etinil-3,6-dimetil-otta-1,7-diene
D) Anche in questo caso non si applica il criterio della precedenza alfabetica per le catene laterali in posizione equivalente (3,6) poiché esiste un’altra catena che risulta essere più vicina all’estremità di destra della catena principale. Si numera dunque la catena principale da destra a sinistra in modo da ottenere la più bassa combinazione numerica possibile. Si ottiene quindi per le catene laterali la combinazione 3,3,6, più bassa della combinazione 3,6,6 che si otterrebbe numerando da sinistra verso destra
Esempio 12
A)

Acido 4-(2-ammino-1-idrossi-propil)-epta-5-enoico
A) La catena principale è la più lunga catena che contiene il gruppo prioritario, in questo caso il gruppo carbossilico (-COOH). Tra le due possibili catene a 7 atomi contenenti il carbossile si sceglie quella che contiene il maggior numero di insaturazioni. Si numera la catena in modo che il gruppo prioritario presenti il numero più basso possibile. Si noti che
B)
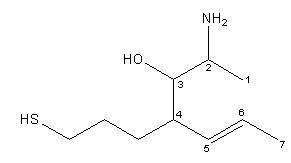
2-ammino-4-(3-mercapto-propil)-ept-5-en-3-olo
B) Sostituendo nella molecola precedente il carbossile (-COOH) con un solfidrile (-SH) il gruppo prioritario diventa l’ossidrile (-OH). La catena principale diventa quindi quella che contiene il gruppo alcolico. Come in precedenza, tra le due possibili catene a 7 atomi contenenti l’ossidrile si sceglie quella che contiene il maggior numero di in saturazioni e si numera la catena in modo che il gruppo prioritario presenti il numero più basso possibile. In questo caso il suffisso diventa –olo (la desinenza degli alcoli)
C)
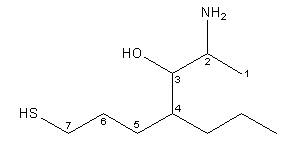
2-ammino-7-mercapto-4-propil-eptan-3-olo
c) Eliminando dalla molecola precedente il doppio legame, la catena principale diventa la più lunga catena contenente il gruppo prioritario (in questo caso l’ossidrile –OH) ed il maggior numero di gruppi funzionali.
Esempio 13
A)

6-ammino-3-cloro-2-mercapto-4-propil-eptan-4-olo
A) La catena principale è la più lunga catena che contiene il gruppo prioritario, in questo caso il gruppo ossidrilico (-OH). Tra le due possibili catene a 7 atomi contenenti il carbossile si sceglie quella che contiene il maggior numero di gruppi funzionali. In questo caso il gruppo prioritario è equidistante dalle due estremità della catena principale e quindi l’ossidrile prenderebbe il numero più basso possibile (4) qualunque sia il verso di numerazione. Anche i gruppi funzionali vicini alle due estremità della catena principale (-NH2 ed –SH) sono equidistanti e prenderebbero comunque la medesima numerazione (2,6). Si numera la catena da sinistra verso destra perché in tal modo si dà al terzo gruppo funzionale (il cloro) la numerazione più bassa: 3 al cloro e 4 al propile. Numerando da sinistra a destra dovremmo assegnare 4 al propile e 5 al cloro.
B)
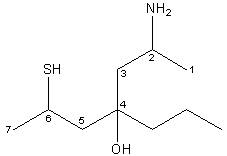
2-ammino-6-mercapto-4-propil-eptan-4-olo
B) Eliminando dalla molecola precedente il cloro, tutti i gruppi funzionali risultano equidistanti dalle due estremità della catena principale. Entrambi i versi di numerazione assegnerebbero la medesima combinazione numerica 2,4,6. Si numera da destra verso sinistra per dare il numero più basso al gruppo, tra i due più vicini alle estremità della catena principale (-NH2 ed –SH), che precede in ordine alfabetico (ammino precede mercapto).
Esempio 14

5-azido-4-idroperossi-6-immino-2-mercapto-4-(1-metossietil)-3-osso-eptanonitrile
Il gruppo prioritario è il nitrile (-C≡N) che dà la desinenza (suffisso) al composto e che individua la catena principale (numerata in nero a partire dal gruppo prioritario). La catena laterale in 4 è un residuo etereo, con il radicale metilico che si lega (tramite l’ossigeno) al radicale etilico in posizione 1 (in rosso)
Esempio 15
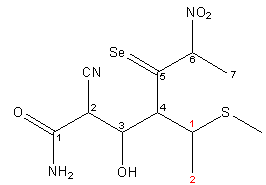
2-ciano-3-idrossi-4-(1-(metiltio)etil)-6-nitro-5-selenosso-eptanammide
Il gruppo prioritario è il gruppo ammidico (-CONH2) che dà la desinenza (suffisso) al composto e che individua la catena principale (numerata in nero a partire dal gruppo prioritario). La catena laterale in 4 è un residuo tioetereo, con il radicale metilico che si lega (tramite lo zolfo) al radicale etilico in posizione 1 (in rosso)
Si definiscono eterociclici i composti ciclici che contengono uno o più eteroatomi (atomi diversi dal carbonio). Si utilizza un prefisso per indicare il tipo di eteroatomo ed una desinenza per indicare le dimensioni dell’anello
Prefissi per eteroatomi |
|||||
As |
arsa- |
O |
ossa- |
Te |
tellura- |
N |
aza- |
Si |
sila- |
Ge |
germana- |
Sb |
stiba- |
Co |
cobalta- |
Pt |
platina- |
B |
bora- |
P |
fosfa- |
Ti |
titana- |
Ni |
nichela- |
Sn |
stanna- |
Ir |
irida- |
Se |
selena- |
Fe |
ferra- |
S |
tia- |
Bi |
bisma- |
Pb |
plumba- |
V |
vanada |
Suffissi per anelli eterociclici |
||||
Anello |
Azotati insaturi |
Azotati saturi |
non azotati insaturi |
non azotati saturi |
3 |
-irina |
-iridina |
-irene |
-irano |
4 |
-ete |
-etidina |
-ete |
-etano |
5 |
-olo |
-olidina |
-olo |
-olano |
6 |
-ina (*) |
-inano |
-ina (*) |
-ano |
7 |
-epina |
(**) |
-epina |
-epano |
8 |
-ocina |
(**) |
-ocina |
-ocano |
9 |
-onina |
(**) |
-onina |
-onano |
10 |
-ecina |
(**) |
-ecina |
-ecano |
(*) Fosfa- diventa fosfor-. arsa- diventa arsen-. stiba- diventa antimon-, per non confonderli con la fosfina PH3, l’arsina AsH3 e la stibina SbH3
(**) al nome del composto insaturo corrispondente si unisce il prefisso peridro-
Eterociclici azotati saturi (esempi) |
|||||||
|
|
|
|
|
|
|
|
aziridina |
azetidina |
azolidina (pirrolidina) |
azinano (piperidina) |
peridroazepina |
peridroazocina |
peridroazonina |
peridroazecina |
Eterociclici non azotati saturi (esempi) |
|||||||
|
|
|
|
|
|
|
|
ossirano |
ossetano |
ossolano (tetraidro furano) |
ossano (tetraidro pirano) |
ossepano |
ossocano |
ossonano |
ossecano |
|
|
|
|
|
|
|
|
tiirano |
tietano |
tiolano (tetraidro tiofene) |
tiano (tetraidro tiopirano) |
tiepano |
tiocano |
tionano |
tiecano |
Negli eterociclici completamente insaturi vi possono comunque essere atomi di carbonio saturi (uniti agli atomi di carbonio adiacenti con legami semplici). Tali atomi sono individuati aggiungendo il prefisso H al nome del composto, preceduto dal numero indicante la loro posizione. Gli atomi dell’anello vanno numerati a partire dall’eteroatomo, il quale prende il numero 1 ed in modo che l’eventuale atomo di carbonio saturo prenda il numero più basso possibile.
Eterociclici azotati insaturi (esempi) |
|||||||
|
|
|
|
|
|
|
|
1H-azirina |
2H-azirina |
azete |
1H-azolo (1H-pirrolo) |
2H-azolo (2H-pirrolo) |
3H-azolo (3H-pirrolo) |
azina (piridina) |
1H-azepina |
|
|
|
|
|
|
|
|
2H-azepina |
3H-azepina |
4H-azepina |
azocina |
1H-azonina
|
2H-azonina
|
3H-azonina |
azecina |
Eterociclici non azotati insaturi (esempi) |
|||||||
|
|
|
|
|
|
|
|
ossirene |
2H-ossete |
ossolo (furano) |
2H-ossina (2H-pirano) |
4H-ossina (4H-pirano) |
ossepina |
2H-ossocina |
ossonina |
|
|
|
|
|
|
|
|
tiirene |
2H-tiete |
tiolo (tiofene) |
4H-tiina (4H-tiopirano) |
tiepina |
4H-tiocina |
tionina |
2H-tiecina |
Gli eterociclici parzialmente saturi, che contengono cioè un numero di doppi legami non cumulati inferiore al numero massimo possibile, possono essere indicati aggiungendo i prefissi diidro (se manca un doppio legame) tetraidro (se mancano due doppi legami) esaedro (se mancano tre doppi legami) e così via, preceduti dal numero che indica la posizione degli atomi di carbonio saturi.
Eterociclici parzialmente saturi (esempi) |
|||
|
|
|
|
1H-fosfepina (saturo) |
2,3-diidro-1H-fosfepina (parz.saturo) |
2,5-diidro-1H-fosfepina (parz.saturo) |
2,3,4,7-tetraidro-1H-fosfepina (parz.saturo) |
Se nell’anello sono presenti più eteroatomi uguali si usano i consueti prefissi mono-, di-, tri- etc... , come ad esempio ditia, triaza-, tetraossa-
Se nell’anello sono presenti più eteroatomi vanno citati seguendo il seguente ordine di priorità decrescente
ossa > tia > selena > tellura > aza > fosfa > arsa
e nel nome si condensano i prefissi. Così ad esempio, il prefisso tiaza- indica la presenza di un atomo di azoto ed uno di zolfo, il prefisso ossadiaza- la presenza di un atomo di ossigeno e due di zolfo. Gli atomi dell’anello vanno numerati in modo che l’eteroatomo a maggior priorità prenda il numero 1 e gli altri eteroatomi prendano il numero più basso possibile
|
|
|
|
|
1,3-diossano |
1,3,5-triazinano |
2H-1,3,4-ossadiazina |
1,4,2-ditiaazinano |
1,2,4-tellurafosfarsolo |
Gli eterociclici costituiti da più anelli condensati di cui uno solo eterociclico. si denominano considerandoli come derivanti da un ciclo base eterociclico
, sul quale sono innestati uno o più cicli; questi ultimi, nel nome, costituiscono il prefisso. Si possono considerare cicli base anche anelli policiclici aventi un nome tradizionale
consacrato dall’uso
Nome tradizionale |
Nome IUPAC |
prefisso |
Antracene |
Antracene |
antra- |
Benzene |
Benzene |
benzo- |
Furano |
Ossolo |
furo- |
Imidazolina |
1,4,5H-1,3-diazolo |
imidazolino- |
Imidazolo |
1H-1,3-diazolo |
imidazolo- |
Naftalene |
naftaline |
nafto- |
Ossazolo |
1,3-ossazolo |
ossazolo- |
Pirano |
2H-ossina |
pirano- |
Pirazina |
1,4-diazina |
pirazino- |
Pirazolina |
1,2H-1,2-diazolo |
pirazolino- |
Piridina |
azina |
pirido- |
|
|
dibenzo-azina (dibenzo-piridina) (acridina) |
dibenzo-1,4-diossina |
Quando tanto il ciclo base quanto quelli usati come prefissi sono
eterociclici, come ciclo base si sceglie preferibilmente:
![Casella di testo: I esempio II esempio III esempio IV esempio ossolo-azina (furo piridina) 1,2,3-triazolo-azina pirido-1,4-diazina (pirido-pirazina) benzo [f]chinolina](classificazione_e_nomenclatura_dei_composti_clip_image159.png)
Per indicare i luoghi in cui è avvenuta la condensazione degli anelli, si adottano lettere e numeri. I lati del ciclo base si contrassegnano con le lettere a, b, c, ecc. Si inizia dalla posizione 1 leggendo in senso orario o antiorario affinchè risulti il minor numero possibile di lettere. In un anello pentatomico i lati sono a (lati 1-2 e 1-5), b (2-3 e 4-5) e c (3-4).
In un anello esatomico i lati sono a (1-2 e 1-6), b (2-3 e 5-6) e c (3-4 e 4-5).
![Casella di testo: benzo[b]azina (chinolina) benzo[c]azina (isochinolina) benzo[b]ossolo (cumarone) benzo[c]ossolo (isocumarone)](classificazione_e_nomenclatura_dei_composti_clip_image164.png)
Quando il ciclo base è biciclico vi sono anche i lati f (5-6), g (6-7) e h (7-8)
![Casella di testo: benzo[g]chinolina benzo[h]chinolina](classificazione_e_nomenclatura_dei_composti_clip_image167.png)
Quando una posizione di condensazione è occupata da un eteroatomo i nomi del ciclo base e del prefisso si scelgono come se entrambi contenessero l’eteroatomo.
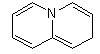
2H-azina[1,2a]azina
Fonte: http://www.scienzaescuola.it/download_files/chimica_organica_esempi_5e.doc
Sito web da visitare: http://www.scienzaescuola.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve