I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
LA MOLE
La massa atomica relativa, MA, di un elemento è la sua massa espressa in unità u, quindi relativamente alla massa dell’atomo di carbonio.
L’unità di massa atomica (u o dalton) è uguale a 1/12 della massa dell’atomo 12C.
La tavola periodica riporta per ogni elemento il valore della massa atomica, chiamata anche peso atomico.
La massa molecolare relativa, MM o peso molecolare, è la somma delle masse atomiche che compaiono nella molecola
Il valore dell’unità di massa atomica, 1 u = 1,661 10-24 g, è estremamente piccolo per essere misurato con gli strumenti a noi conosciuti.
È stato perciò necessario trovare una grandezza che mettesse in relazione gli atomi e le molecole con le grandezze misurabili con le bilance.
Questa grandezza è la mole (mol).
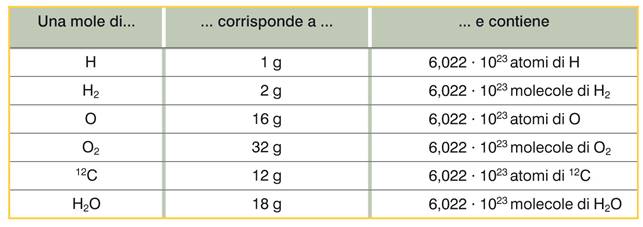
Una mole è la quantità di sostanza che contiene un numero di particelle elementari uguali al numero di atomi contenuti in 12 g di 12C.
La massa di una mole di un elemento (o di una molecola) è uguale alla sua massa atomica (o molecolare) espressa in grammi/mole.
La massa molare M che si misura in g/mol, è la massa di una mole.
Avogadro si pose il problema di quante particelle elementari fossero contenute in una mole e lo risolse tramite il rapporto:
massa molare/massa atomica = NUMERO PARTICELLE ( o N) presenti in una mole
Il risultato del rapporto
massa molare/massa atomica = 6,022 X 1023 particelle/moll
è noto come numero o costante di Avogadro.
Una mole di sostanza contiene sempre 6,022 X 1023particelle (atomi, molecole o ioni).
 In pratica, per calcolare il numero di moli di una sostanza si usa la formula
In pratica, per calcolare il numero di moli di una sostanza si usa la formula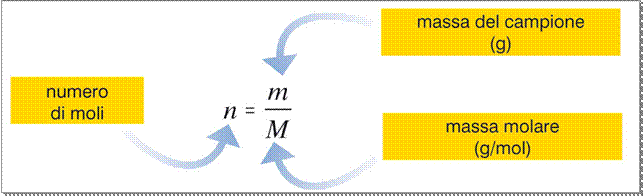
Con l’analisi qualitativa e quantitativa si calcolano sperimentalmente le percentuali in massa degli elementi, da cui si ricava la formula minima del composto.
La composizione percentuale è utile per determinare la massa effettiva di un elemento presente in una data massa di composto.
I passaggi per determinare la formula minima sono i seguenti:
si scrive la massa m in grammi di ciascun elemento presente in 100 g di composto, cioè la sua percentuale in massa;
si calcola il numero di moli n di ciascun elemento;
si divide il numero di moli di ciascun elemento per il più piccolo numero di moli calcolato: i numeri interi che si ottengono sono gli indici numerici della formula;
si scrivono gli elementi e in basso a destra di ciascuno il rispettivo indice.
Fonte: http://www.linguisticolambruschini.it/classe2.0/images/CHIMICA/la_mole/La_mole.doc
Sito web da visitare: http://www.linguisticolambruschini.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve