

I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Che senso ha ciò che stiamo imparando 2
Strutture elettroniche
Gli atomi degli elementi della seconda riga del sistema periodico hanno due elettroni nello strato interno, coincidente con l’orbitale 1s, e un nucleo con carica che va da +3, per il Litio, e arriva a 10 col Neon. Di conseguenza i noccioli di questi atomi hanno carica positiva crescente/decrescente.

Scrivi le cariche approssimative nei noccioli grigi.
Poiché gli elettroni di valenza sono legati con forza crescente/decrescente al nocciolo e al nucleo, l’orbitale 1s, il nocciolo e l’intero atomo, hanno dimensioni crescenti/decrescenti fino al fluoro. L’elettronegatività (la tendenza di un atomo ad attrarre gli elettroni degli altri atomi nella propria sfera di valenza, quando è legato) aumenta/diminuisce di mezza unità per ogni casella che si avanza dal Litio al Fluoro. Inoltre, mentre gli atomi del …. e del …. possono perdere facilmente elettroni formando rispettivamente ioni ….. e ……, gli atomi di N, O ed F, in aggiunta alla formazione di legami covalenti, possono catturare ulteriori elettroni per completare l’ottetto, formando rispettivamente ioni …… (nitruro), ……. (ossido) e …….(fluoruro). Il carbonio, elemento centrale e “mediocre” per elettronegatività, preferisce la condivisione degli elettroni, cioè la formazione di legami covalenti. Gli elettroni del guscio di valenza sono disposti nell’orbitale 2s e negli orbitali 2px, 2py e 2pz. Secondo la comoda notazione di Lewis, tali elettroni si possono indicare con dei semplici puntini disposti intorno al simbolo dell’elemento, nelle quattro posizioni sopra, sotto, sinistra e destra, corrispondenti ai quattro orbitali. Nella disposizione si “dimenticano” le distinzioni tra orbitali s e p, e si cerca di lasciare il maggior numero possibile di elettroni spaiati, cioè si “predispone” l’atomo a formare il maggior numero di legami possibili. Per cui avremo le seguenti rappresentazioni secondo Lewis:
Li |
Be |
B |
C |
N |
O |
F |
Si giustificano in tal modo le formule dei composti binari idrogenati, in cui ogni elettrone spaiato è condiviso con un elettrone dell’atomo di idrogeno:
|
|
|
|
|
|
|
Lithium hydride |
Berillium hydride |
Boron Hydride |
Methane |
Ammonia |
Water |
Hydrogen fluoride |
Solo dal metano in poi si raggiunge l’ottetto. Il boro può raggiungerlo ricevendo una coppia di elettroni da un ulteriore atomo di idrogeno sotto forma di ione negativo, per es. :H¯ (idruro):

Il legame formato per condivisione di una coppia di elettroni provenienti da un atomo “donatore” verso un atomo che ha un orbitale libero (accettore) è chiamato covalente dativo in virtù della particolare dinamica “sbilanciata”. Si deve tenere presente, però, che una volta formato il legame è perfettamente equivalente agli altri legami covalenti, tanto che il BH4¯ è perfettamente tetraedrico e simmetrico. Utilizziamo lo ione borotetraidruro per renderci conto dei due diversi modi per contare gli elettroni intorno a un atomo .
a) per verificare l’ottetto, contiamo tutti gli elettroni condivisi nello strato di valenza, anche quelli portati dagli altri atomi. In tal caso il boro di BH4¯ ha quattro coppie di legame, dunque: 8 elettroni, ottetto completo = struttura stabile come quella del neon.
b) Il conteggio per conoscere la carica formale dell’atomo. In tal caso per ciascun legame singolo si considera come appartenente all’atomo solo un elettrone, mentre le eventuali coppie libere appartengono per intero all’atomo. Una volta contati gli elettroni in questo modo si vede la differenza rispetto agli elettroni di valenza dell’atomo neutro per risalire alla carica. Poiché il boro forma quattro legami nel BH4¯, si considerano 4 elettroni come appartenenti ad esso, cioè uno in più rispetto alla norma, quindi si assegna carica -1 al boro. In base a questa regola il boro è sempre neutro quando forma tre legami, come sono sempre neutri il carbonio con quattro legami, l’azoto con tre legami e un doppietto, l’ossigeno con due legami e due doppietti e l’alogeno (F, Cl, Br, I) con un legame e tre doppietti. Se questi atomi formano un legame in più, diventano negativi se ricevono un legame dativo o positivi se utilizzano una coppia di elettroni per formare un legame dativo aggiuntivo. Abbiamo pertanto il seguente schema di riferimento, da completare con le cariche necessarie su N, O e X (X = alogeno, F, Cl, Br, I).

Esercizio: nelle seguenti strutture indica le coppie elettroniche necessarie affinché tutti gli atomi raggiungano l’ottetto e determina le cariche degli atomi.
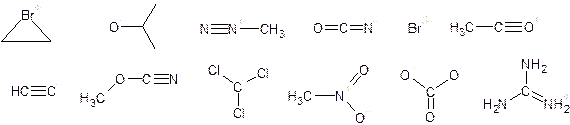
Polarità e solubilità
1. polarità dei legami
Un legame covalente è polare quando gli elettroni di legame non sono condivisi equamente e ciò si verifica se i due elementi hanno elettronegatività (capacità di attirare gli elettroni di legame) diverse. Le elettronegatività (scala Pauling) si ricavano dalla tavola periodica.
Il la polarità di un legame comporta un carica positiva parziale (< 1 e) centrata su un atomo e una carica negativa di valore opposto, centrata sull’altro atomo del legame.
1. Stabilisci quali di questi legami possono considerarsi polari (differenza di elettronegatività > 0,4) e indica con d+ e d¯ l’atomo con carica parziale positiva e quello con carica parziale negativa.
a) C-O b) C-H; c) C-N; d) N-H; e) C-S; f) C-C; g) C-Cl; h) C-I; i) S-S; l) C-Mg
L’elettronegatività aumenta all’aumentare della carica del nocciolo (che esercita l’attrazione sugli elettroni di valenza) e diminuisce all’aumentare delle dimensioni dell’atomo (poiché la forza di attrazione diminuisce all’aumentare dalla distanza dal centro di attrazione) . Per queste ragioni l’elettronegatività tende ad aumentare spostandosi verso destra in un periodo (aumento della carica del nocciolo) e diminuisce verso il basso, lungo i gruppi (aumentano le dimensioni atomiche).
2. Dove si trovano e quali sono i tre elementi più elettronegativi della tavola periodica?
3. Qual è il legame più polare che si può ottenere tra due elementi del blocco p (gruppi IIIA – VIIA)?
Un legame si considera ionico quando la differenza di elettronegatività è così alta che gli elettroni di legame smettono di essere minimamente condivisi e sono praticamente catturati dal più elettronegativo dei due atomi. Questo diventa uno ione negativo, mentre l’altro atomo, avendo perduto uno dei suoi elettroni, rimane con una carica del nocciolo scoperta (ione positivo).
4. In base a questo criterio, cerca nella tavola periodica un elemento che col carbonio possa formare un legame ionico.
A determinare la polarità non è solo la differenza di elettronegatività, comunque, ma anche la distanza tra i nuclei: un legame è più polare quando è più lungo, a parità di differenze di elettronegatività. Il momento dipolare è dato infatti dal prodotto della carica elettrica per la distanza.
5. Considerando che le elettronegatività del cloro e dell’azoto sono uguali, stabilire se sarà più polare il legame C-N o quello C-Cl.
6. Per alcune molecole è stata invocata una struttura ionica anziché covalente, nonostante si tratti di sostanze gassose. Quale tra le seguenti può ritenersi una molecola – ione?
A) SiF4; B) CF4; C) SiH4; D) CCl4; E) CH4
2. polarità delle molecole
La polarità delle molecole è un argomento più complesso della polarità del singolo legame. Infatti non sempre le molecole comprendenti legami polari sono a loro volta dei dipoli elettrici, poiché, se la disposizione dei dipoli è simmetrica, questi si annullano e la molecola risultante è apolare. Un esempio è costituito dal CCl4, tetraclorometano, dove il centro dei quattro d- degli atomi di cloro coincide con l’atomo di C centrale, cioè con il d+. Nella molecola del CH2Cl2, invece, dove i due legami C-Cl sono rivolti verso lo stesso lato della molecola e non sono controbilanciati da altri dipoli opposti, per cui si sommano e rendono la molecola polare. Perciò la regola è facile: se la molecola è simmetrica non è un dipolo; se è asimmetrica sarà polare quando conterrà legami polari. I legami C-H non si considerano polari.
7. stabilisci quali molecole sono dei dipoli elettrici (polari).
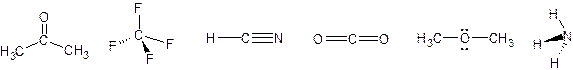
Anche dall’esercizio si capisce che una molecola è simmetrica, quindi non dipolare, quando possiede tutti gruppi identici. Ciò implica che se l’atomo centrale ha una o più coppie solitarie, non potrà essere simmetrica.
Solubilità
Mentre le molecole apolari sono sempre discretamente solubili in solventi apolari (es. CCl4) o poco polari (es. acetone, CH2Cl2), la questione della solubilità in acqua è più complessa da determinare, e impossibile da stabilire con certezza anche conoscendo bene la struttura molecolare. Però sono utili tutte le conoscenze di questa lettura (polarità dei legami, polarità delle molecole) e, in aggiunta, il concetto di legame a idrogeno. Il legame a idrogeno non è un legame covalente interno a una molecola, ma un legame che unisce debolmente due diverse molecole, tramite un atomo d’idrogeno che fa da “ponte” e che soddisfa i seguenti requisiti:
a) H è legato covalentemente ad un atomo di Fluoro, Ossigeno od Azoto, i tre atomi più piccoli e insieme più elettronegativi della tavola periodica; questa caratteristica fa sì che l’atomo H abbia una forte polarità positiva;
b) nell’altra molecola legata deve esistere un atomo di Fluoro, Ossigeno Azoto. Le coppie elettroniche libere di questi atomi possono attrarre l’idrogeno d+ dell’altra molecola, completando il ponte;
c) l’atomo F, O, N di una molecola, l’idrogeno legato a uno di questi, e l’atomo F, O, N dell’altra molecola devono potersi allineare a 180°, o poco meno, per dar luogo alla massima forza di attrazione (che comunque è 10 volte inferiore a quella di un tipico legame covalente).
8. In quale di questi tre casi non può formarsi il legame a idrogeno(indicato dalla linea tratteggiata)?

9. Disegna un legame a idrogeno tra due molecole d’acqua e una disposizione alternativa per il legame a idrogeno ammoniaca – acqua.
Ora che abbiamo tutti gli elementi chiave, possiamo stabilire una regola per la solubilità in acqua: indipendentemente dal fatto che la molecola organica sia un dipolo o meno, la solubilità dipenderà dalla presenza di atomi capaci di formare legami a idrogeno con l’acqua. In particolare, ogni gruppo capace di dare legami a idrogeno potrà supportare la solubilità in acqua di un massimo di tre atomi di carbonio apolari. Le molecole con gruppi polari incapaci di dare legami a idrogeno, o capaci solo di ricevere legami a idrogeno, hanno in genere solo una parziale solubilità in H2O. Un tipico esempio è la CO2, apolare e in parte solubile in acqua. Ovviamente la solubilità sarà tanto maggiore quanto più forte sarà il dipolo, come abbiamo visto per la serie a solubilità crescente:
0 » tetraclorometano (CCl4) < triclorometano o cloroformio (CHCl3) < diclorometano (CH2Cl2).
10. Applica i criteri 1H-3C e del dipolo molecolare per valutare se queste molecole sono molto solubili in acqua (++), poco solubili in acqua (+) o con solubilità quasi nulla (-).

Un parametro molto importante di una sostanza è il coefficiente di ripartizione ottanolo/acqua, o meglio il logaritmo decimale di questo valore, noto come LogPow (la P sta per partition, o ripartizione, la o per octanol e la w per water). Esso indica la maggiore o minore propensione della sostanza a distribuirsi nella catena alimentare, poiché i lipidi, negli organismi viventi, sono poco polari, dunque capaci di sciogliere sostanze poco polari, che preferiscono lo strato di ottanolo a quello acquoso. In laboratorio tale valore ci dice se la sostanza è o meno estraibile con un solvente. Se una sostanza ha logPow = 2 significa che ci sono due zeri nel rapporto tra le concentrazioni in ottanolo e acqua, ovvero che la sostanza è 100 volte più solubile in ottanolo che in acqua. Per il tetraclorometano, CCl4, il LogPow è 2,83, il che significa che tale sostanza è quasi mille volte più solubile in ottanolo che in acqua. Se invece il LogPow è -2 significa che la sostanza è 100 volte più solubile in acqua che in ottanolo, cioè che il suo coefficiente di ripartizione è 0,01. Per l’acetone il LogPow è -0.24, indicando che l’acetone è poco più solubile in acqua che in ottanolo.
11. Trova nei data base il LogPow e la solubilità in acqua delle sostanze che saranno utilizzate nella prossima attività di laboratorio: trifenilmetanolo, acido benzoico, caffeina.
Procedimento:
a) trovare il nome in inglese (per es. dal traduttore di Google, che però funziona solo per i nomi non troppo inusuali) o la formula molecolare (da un catalogo, o dalla formula di struttura). Se il catalogo riporta direttamente il CAS (Chemical Abstract Source) utilizzare direttamente questo valore saltando alla fase c)
b) Dal sito di chimica www.divini.net/chimica selezionare NIST e inserire un nome inglese della sostanza scegliendo name, o la formula bruta, es C5H8O2, se si sceglie formula. Una volta selezionata la sostanza desiderata (potrebbero presentarsi diversi isomeri tra cui individuare quello voluto) selezionare il codice CAS (tre gruppi di cifre).
c) Sempre dal sito di chimica cliccare sul data base Phys Prop (richiede il CAS), inserire tale codice senza spazi o altri caratteri extra e dare OK. Apparirà un elenco di tutte le proprietà della sostanza, compreso il LogPow e la solubilità in acqua in mg/L.
12. Quale tra queste tre sostanze dovrebbe essere maggiormente solubile in acqua?
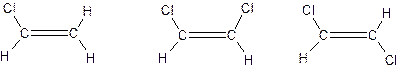
Verifica la tua previsione utilizzando i data base secondo la procedura appena vista.
L’idruro di boro più stabile non ha la formula molecolare da te scritta, ma quest’altra: http://en.wikipedia.org/wiki/Image:Diborane-2D.png . In essa non ci sono idrogeni bivalenti, ma legami “a banana” formati da tre centri e due elettroni. Quindi i due atomi di Boro non completano l’ottetto. Se consideriamo gli atomi di idrogeno “ponte” come facenti parte dei legami boro-boro, avremo un diverso punto di vista secondo cui ogni boro ha 8 elettroni nella sfera di valenza. Nessuno ha mai domandato al boro quale sia il suo punto di vista.
Esiste una terza convenzione per assegnare gli elettroni a un atomo, finalizzata a determinare il numero di ossidazione di un atomo: in questo caso gli elettroni di un legame sono tutti assegnati al più elettronegativo dei due atomi legati. Nel legame tra due atomi identici la coppie è ripartita equamente. Non intervengono nel calcolo gli elettroni delle coppie solitarie. Il numero di ossidazione è la carica convenzionale risultante da questo calcolo.
Vedremo che l’elettronegatività di un atomo non è una costante. Essa dipende anche da quali orbitali l’atomo utilizza per un dato legame (maggiore per gli orbitali s e minore per gli p) e dipende dall’”intorno” dell’atomo, cioè dalla capacità degli atomi ad esso legato di attrarre o donare elettroni. L’elettronegatività del carbonio, ad esempio, può variare da 2,5 (sp3) a circa 3,0 (sp).
Fonte: http://www.divini.net/dc/courses/3CH08/document/strutture_elettroniche.doc?cidReq=3CH08
Sito web da visitare: http://www.divini.net/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve