I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
generalità:
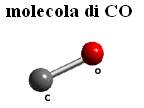
C=O
In realtà la struttura di Lewis con doppio legame C=O contrasta con diversi dati:
legame |
kJ/mol |
CºO |
1076 |
-CºN |
887 |
NºN |
942 |
-CºC- |
835 |
O=O |
494 |
>C=C< |
600 |
>C=O |
800 |
Inoltre la teoria degli orbitali molecolari prevede per questa molecola, isoelettronica con N2 (NºN), un ordine di legame tre, con una componente ionica che va a sommarsi al triplo legame. Pertanto la struttura che soddisfa tutte queste evidenze e giustifica la relativa inerzia del mossido di carbonio, presenta piuttosto un triplo legame:
-:CºO:+
Reazione elementare per la formazione del monossido di carbonio:
2C + O2 —> 2CO
Scheda generalità:
Nome sostanza |
monossido di carbonio |
Nome IUPAC |
ossido di carbonio (II) |
Formula bruta |
CO |
Massa molecolare (uma) |
28,01 |
Densità |
1,145 |
Temperatura di fusione |
-205°C (68°K) |
Temperatura di ebollizione |
-192°C (81 °K) |
Frasi R: |
R12: Estremamente infiammabile. R23: Tossico per inalazione. R61: Può danneggiare i bambini non ancora nati R:48/23: |
Frasi S: |
S45: In caso d'infortunio o di malore, consultare immediatamente un medico (recare possibilmente con sé l'etichetta). S53: Evitare l'esposizione, procurarsi istruzioni particolari prima dell'utilizzazione. |
Indicazioni di sicurezza
|
|
Sistema di rivelazione del CO |
Strumento IR (banda stretching a 2140 cm-1 o 4670 nm) |
Intro
Pochi sanno che esistono ben cinque ossidi di carbonio stabili: CO, CO2,
C3O2, C5O2 e C12O9 quest'ultimo è la trianidride dell'acido
benzenesacarbossilico, o acido mellitico, in pratica tale ossido si ottiene
eliminando tre molecole d'acqua dai 6 carbossili attaccati ai sei
carboni del benzene.

Ci sono inoltre tre ossidi instabili, C2O, C2O3 e CO3.
Il sottossido di carbonio, C3O2, è un gas maleodorante e incolore che si
forma disidratando l'acido malonico con anidride fosforica a 140-150 °C.
La sua struttura è probabilmente lineare:
struttura bidimensionale struttura tridimensionale
sottossido di carbonio sottossido di carbonio

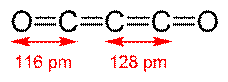
con doppi legami cumulati (=C=C=C=) e i due ossigeni all'estremità della
catena. Le strutture di risonanza che stabilizzano tale ossido sono
possibili sono con un numero dispari di carboni. Con n = 1, 3, 5 possiamo
prevedere pertanto l'esistenza dei composti OCnO, ovvero di OCO (diossido di
carbonio), OCCCO (sottossido di carbonio) e OCCCCCO. Per azione della luce
OCCCO si decompone in C2O instabile (monossido di dicarbonio) e in CO,del quale tratteremo più approfonditamente nelle pagine seguenti.
Cos’è il monossido di carbonio?
Il monossido di carbonio, si crea dalle combustioni parziale di sostanze organiche, (come carbone, carta, benzina, nafta, gas, legno, ecc) quando vi è una bassa concentrazione di ossigeno
È un gas incolore, inodore ed insapore che si miscela molto bene con l’aria ( anche essendo più leggero di quest’ultima ) e può facilmente penetrare attraverso soffitti e pareti, caratteristiche sicuramente poco favorevoli per l’uomo in quanto il monossido di carbonio è anche tossico.
È uno dei fattori d’inquinamento atmosferico più diffuso in questo secolo.
il monossido di carbonio reagisce con soluzioni dei metalli alcalini in ammoniaca liquida, formando lo ione esotico ¯OCCO¯ (C2O22-) e questa sostanza è usata principalmente, prodotta da carbon coke e aria, alla base dell’altoforno, come riducente dei minerali ferrosi nella produzione dell’acciaio.
Tossicità e danni
Vi sono molti casi che riguardano l’intossicazione da monossido di carbonio, alcuni dei quali sono finiti in tragedia causando alle vittime di questo subdolo gas la morte per asfissia (o la così detta “morte rosa”).
Esistono vari livelli di intossicazione che vengono classificati in base alla percentuale di CO presente nel sangue
Essi sono:
le varie intossicazioni presentavo diversi sintomi l’una dall’altra ecco un elenco dettagliato.
Classe di gravità |
Sintomi e segni |
Lieve |
cefalea, nausea, vomito, astenia |
Media |
confusione mentale, lentezza di ideazione, visione offuscata, debolezza, atassia, anomalie comportamentali, dispnea da sforzo, tachicardia. |
Grave |
disorientamento, sopore, convulsioni, alterazioni alla TAC dell'encefalo, ipotensione, dolore toracico, aritmie, edema polmonare, acidosi lattica, sincope, coma |
La sua elevata tossicità per gli esseri viventi è dovuta alla sua forte affinità con l’emoglobina .
L’emoglobina è la componente principale dei globuli rossi, è formata da circa 10000 atomi di idrogeno, carbonio, ossigeno e in più quattro atomi di ferro, che sono il suo elemento più importante, in quanto questi ultimi stanno al centro di un gruppo di atomi che formano il pigmento chiamato eme ed è grazie a questa componete che i globuli rossi sono capaci di legarsi e trasportare l’ossigeno a tutti gli organismi nel corpo.
In presenza del monossido di carbonio comunque le cose cambiano, infatti l’affinità che l’emoglobina ha con questa sostanza è 200 volte più alta di quella che possiede con l’ossigeno e forma così la carbossiemoglobina(HbCO).
La conseguenza della presenza di questa sostanza è la saturazione dell’emoglobina che non può più legarsi con l’ossigeno formando così la ossiemoglobina(HbO2) e di conseguenza L’O2 non può più essere trasportato agli organi del corpo causando, in questo modo, gravi danni agli organi in particolare al cervello e al cuore ( dato che hanno bisogno di molto ossigeno per poter svolgere il loro compito) la perdita dei sensi e di seguito la morte.
 Molecola dell’emoglobina: Formula eme:
Molecola dell’emoglobina: Formula eme:


Fonti della produzione di monossido di carbonio
Il monossido di carbonio può essere prodotto tramite diverse fonti tra le quali ci sono molti strumenti che sono presenti nelle case tipo, i fornelli, le stufe, gli impianti di riscaldamento a gas quando queste apparecchiature sono difettose,dai camini quando non si trovano in locali ben ventilati . queste apparecchiature ad ogni modo si utilizzano specialmente in inverno e il livello di monossido di carbonio non dovrebbe essere molto alto, invece no, perché questo gas letale viene prodotto anche da cose di utilizzo quotidiano quali l’automobile e le sigarette.
Principalmente per quest’ultime due fonti la popolazione urbana è decisamente esposta a dosi di monossido di carbonio ogni giorno, principalmente se si trova in grandi città.questa lenta intossicazione prende il nome di ossicarbonismo e si manifesta con sintomi nervosi e respiratori.
È stata scoperta dal team di ricerche della clinica mayo la presenza di monossido di carbonio nell’apparato digerente che funge da regolatore dei muscoli lisci del tratto gastrointestinale.
Il cibo, grazie alle contrazioni del monossido di carbonio prodotto di continuo da cellule poste sulle pareti intestinali, si sposta nell’apparato digerente.
Ogni variazione della quantità del monossido di carbonio in quest’apparato ne determina il suo buon funzionamento, fortunatamente la produzione di CO viene bilanciata da un gradiente, spesso alcuni millimetri che riesce a ricalcare in questo modo l’usuale fisiologia dell’apparato tramite questo micidiale gas.
Come proteggersi ?
Per proteggersi dalle varie intossicazioni da CO, vi sono delle precauzioni che sarebbe meglio tenere a mente.
Esse sono:
Nicheltetracarbonile
Esiste una sostanza che si può ottenere dalla sintesi diretta del monossido di carbonio con il nichel metallico ovvero il nicheltetracarbonile , detto anche tetracarbonilnichel (Ni(CO)4 ).
Questo complesso organometallico ( ovvero che contiene un legame metallo-carbonio) fu scoperto da Ludwig Mong nel 1890.
Ottenere questa sostanza è piuttosto semplice in quanto il nichel metallico reagisce direttamente con il monossido di carbonio a temperatura ambiente .
La sua struttura è formata da una molecola di nichel al centro legata a 4 molecole di CO.
Molecola tridimensionale
nicheltetracarbonile

Il nicheltetracarbonile si presenta come un liquido incolore ma al contrario del suo aspetto “semplice” viene ignorata la sua grande pericolosità, infatti è una sostanza altamente infiammabile , esplosiva e soprattutto estremamente tossica.
La principale causa dell’avvelenamento da nicheltetracarbonile è dovuta alla sua inalazione in quanto è estremamente volatile, ma pur essendo il caso più frequente quello appena descritto non è l’unico modo per rischiare un’ avvelenamento, infatti si può essere intossicati da questa sostanza anche dal semplice contatto con la pelle.
Vi sono due stadi dell’intossicazione da nicheltetracarbonile :
Il periodo di convalescenza è estremamente lungo e faticoso in quanto si manifestano sintomi come depressione, mancanza di forze ( astenia) e mancanza di respiro durante gli sforzi (dispnea da sforzo) anche se ad ogni modo questi danni non sono permanenti.
Se non vi si accorge di questa intossicazione entro 4 giorni può sopraggiungere la morte per insufficienza cardiorespiratoria o renale
Utilizzi monossido di carbonio.
Il monossido di carbonio, al contrario di quanto si pensa, non è solo una sostanza pericolosa, ma può anche rivelarsi un ottimo combustibile in quanto, quando viene bruciato, rilascia una buona quantità di calore, infatti la sua entalpia standard di formazione è di
ΔH° (gas) = -565.53 kJ/mol.
Per fruttare i vantaggi di questa sostanza di solito si mescola con altre sostanze dando vita a nuovi gas. Tre tra i prodotti più conosciuti sono il gas d’aria, il gas da carbone e il più importante dei tre in gas d’acqua
Il gas d’acqua, detto anche “gas blu” per via della sua fiamma durante la combustione di colore blu, è una miscela gassosa composta dal monossido di carbonio e dall’idrogeno e viene prodotto facendo passare su uno strato di coke incandescente ( 1400°C) del vapore d’acqua dando luogo alla reazione:
H2O + C = CO + H2
Il gas d’acqua viene utilizzato tale e quale per molti e vari scopi, ma si può utilizzare anche miscelato con altri gas quali il gas d’aria (diventando così un carburante alternativo nelle auto a gasogeno) oppure per usi cittadini con il gas d’olio.
L’impianto per la sua produzione occupa poco spazio e si può mettere in funzione quando lo si desidera . di solito se l’impianto produce gas per usi cittadini rimane in attivo per tutto il periodo estivo in quanto l’utilizzo del gas è minore, quando viene rimesso in funzione nelle stagioni invernali non servono accorgimenti particolari al di fuori dei controlli di routine in quanto anche se disattivato si mantiene in ottime condizioni
Apparecchiatura :
l’impianto per la produzione di gas d’acqua è composto da :
Tutti questi materiali sono di forma cilindrica simili nella grandezza e tutti dello stesso materiale ovvero il ferro.
Produzione:
Per poterlo ottenere si devono effettuare diverse fasi:
queste operazioni sono essenziali, perché essendo tutto il processo una reazione endotermica (e il calore perso per colpa di questa caratteristica si aggiunge a quello perso per irradiazione ), la temperatura del gas diminuisce e se giunge sotto i 1000°C, il vapore e il coke reagiscono in modo diverso e danno vita alle seguente reazione:
2H2O+C à CO+2H2
Il monossido di carbonio viene così rimpiazzato dall’anidride carbonica che risulta come un prodotto indesiderato in questo tipo di processo, in quanto non è combustibile
Fonte: http://www.divini.net/chimica/tesine/Monossido_di_carbonio_finale_rev.doc
Sito web da visitare: http://www.divini.net/chimica
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve