I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Esercizio 1
![]() =
= 
![]() =
= ![]()
Esercizio 2
Nomenclatura di B, (B+1), (B+2):
Formula di B, (B+1), (B+2):
Esercizio 3
![]() ;
; ![]() ; Massa di KI= M(KI) = c ×M = c×d×V;
; Massa di KI= M(KI) = c ×M = c×d×V;
Massa di acqua = M(H2O)= (1-c)×d×V
Massa di KI in 1000 g di acqua c×d×V : (1-c)×d×V = x : 1000, ![]()
m(KI) = x/MM(KI)
n(KI) = c×d×V/MM(KI); n(H2O)= (1-c)×d×V/MM(H2O)
![]()
Esercizio 4
n(CH3COOH) = 100 × (A+1) ×10-2 ; n(NaOH) = 25 × 4× (A+1) ×10-2 = 100 × (A+1) ×10-2, cioè
n(CH3COOH) = n(NaOH). Il sistema è una soluzione di acetato di sodio, CH3COONa, che dà idrolisi basica. n(CH3COONa) = n(NaOH) = n(CH3COOH) = 100 × (A+1) ×10-2 millimoli, sciolte in un volume V = 125 mL.
c(sale) = (100/125)×(A+1) ×10-2 = (A+1)/125; pKi = 14 - pKa
pH = 14 – pOH = 14 – 0.5×[pKi – log10 c(sale)]= 14 – 0.5×[14 – pKa – log10 c(sale)] =
= 7+0.5×[ pKa + log10 c(sale)] = 9 + 0.5× log10[((A+1)/125] = 7.95+ 0.5× log10[((A+1)]
Esercizio 5
Esercizio 6
DrCp = - R.
DrH(T2) = DrH(T1) – 10 R =[(A+10) - 8.314×10-3] kJ mol-1
Esercizio 7
![]()
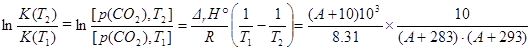
Esercizio 8
 ,
,
Esercizio 9
-ln(1-a) = k * ta, quindi k = - ln(0.9) / [10*(A+1)] min-1
Quiz di Chimica Fisica
Un gas reale può essere liquefatto se
|
mai |
T < Tc |
sempre |
(dG/dT)p =
|
H - S |
-S |
Cp/T |
Dimensioni del calore specifico molare a pressione costante e corrispondenti unità di misura |
[Energia] ´ mole ´[T] J mol K |
[Energia] ´ mole-1´[T] -1 J mol-1 K-1 |
[Energia] ´[T] –1 J K-1 |
una soluzione acquosa di NaCl ha:
|
p(H2O) < p(H2O)* |
p(H2O) > p(H2O)* |
p(H2O) = p(H2O)* |
Il punto triplo di un sistema ad un solo componente ha varianza |
0 |
1 |
2 |
Al punto eutettico di un sistema a due componenti a pressione costante, coesistono |
2 fasi |
3 fasi |
4 fasi |
Il flusso di solvente tra una soluzione con aW = 0.9 e una soluzione con aW = 0.8, separate da un setto semipermeabile, avviene: |
da quella con aW = 0.9 verso quella con aW = 0.8 |
da quella con aW = 0.8 verso quella con aW = 0.9 |
Il flusso non riguarda il solvente, ma il soluto |
L’ equazione di Arrhenius permette di prevedere che |
Una reazione impossibile a temperatura ambiente diventa spontanea a temperature più elevate |
Una reazione lenta a temperatura ambiente ha velocità maggiore a temperature più elevate |
Una reazione esotermica è più veloce di una reazione endotermica |
L’equazione di vant’Hoff permette di prevedere che |
La variazione della entropia di reazione al variare di T |
La variazione della costante di equilibrio al variare di T |
La variazione della entalpia di reazione al variare di T |
Lo stato standard di un composto chimico è definito come |
Sostanza pura nello stato fisico stabile alla T considerata per p = 105 Pa e, se questo è gassoso, con comportamento ideale |
Sostanza pura nello stato fisico stabile alla T = 298,15 K a qualunque pressione |
Sostanza pura nello stato fisico gassoso con comportamento ideale |
Fonte: http://www.agraria.unimi.it/bacheche/upload/G29/1374514811_soluzioni%2022%20luglio.doc
Sito web da visitare: http://www.agraria.unimi.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve