I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
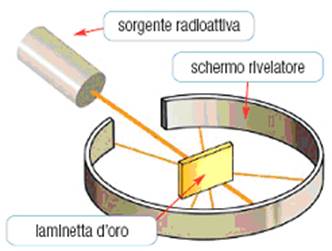 Modello atomico di Rutherford
Modello atomico di Rutherford
Rutherford, nel 1911, in uno dei suoi tanti esperimenti divenuti famosi per la semplicità e la genialità dell'impostazio-ne, dimostrò che l'atomo non poteva ave-re una struttura omogenea, come l'imma-ginava Thomson, ma doveva possedere un nucleo di dimensioni molto piccole e di carica elettrica positiva, nel quale era concentrata praticamente tutta la sua massa.
L'esperimento di Rutherford, nelle sue linee essenziali, consistette nel lanciare, contro una sottilissima fogliolina d'oro, le particelle a emesse spontaneamente dalle sostanze radioattive ed osservare la loro deviazione (il cosiddetto scattering).
Egli così poté notare che la quasi totalità di queste particelle passava indisturbata attraverso la lamina d'oro, ma che una piccola percentuale di esse subiva delle deviazioni.
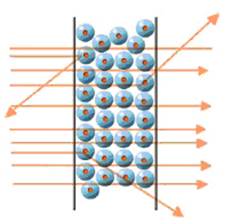 Si trattava normalmente di deviazioni di minima entità ma, cosa sorprendente ed imprevista, alcu-ne particelle deflettevano notevolmente e a volte venivano addirittura respinte all'indietro. "Era l'evento più incredibile che mi fosse mai capitato di vedere; - commentò successivamente lo stesso Rutherford - era come sparare un proiettile contro un foglio di carta velina e vederselo tornare indietro, a colpire chi l'aveva sparato".
Si trattava normalmente di deviazioni di minima entità ma, cosa sorprendente ed imprevista, alcu-ne particelle deflettevano notevolmente e a volte venivano addirittura respinte all'indietro. "Era l'evento più incredibile che mi fosse mai capitato di vedere; - commentò successivamente lo stesso Rutherford - era come sparare un proiettile contro un foglio di carta velina e vederselo tornare indietro, a colpire chi l'aveva sparato".
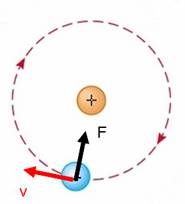
Questa osservazione non poteva che avere un’ unica spiegazione: l'ato-mo, nel suo complesso, era un edificio vuoto, con tutta la massa concentrata in un nucleo centrale carico positiva-mente, molto piccolo e di conseguenza anche molto denso. Gli elettroni, necessariamente, dovevano muoversi su ampie orbite, intorno al nucleo, come i pianeti ruotano intorno al Sole, grazie all’azione combinata di due forze: quella di attrazione del nucleo quella centrifuga dovuta alla velocità di rotazione. Per questo motivo, il modello atomico di Rutherford, venne anche detto modello planetario.
I fatti sperimentali mostravano che il nucleo doveva possedere dimensioni di circa 10.000 volte minori di quelle dell'atomo intero. Per farci un'idea di queste dimensioni possiamo immaginare di ingrandire un atomo fino a fargli assumere le dimensioni di un ampio salone: il nucleo, al centro, non sarebbe più grande della capocchia di uno spillo.
Il periodo che precede il 1900 è quello classico, caratterizzato da teorie fisiche solide (in particolare Meccanica ed Elettromagnetismo) ma dalla sostanziale separazione fra di esse. Questo insieme di teorie non è in grado di spiegare quasi nulla al livello atomico sicché la chimica e la nascente fisica atomica erano prive di una solida teoria di base.
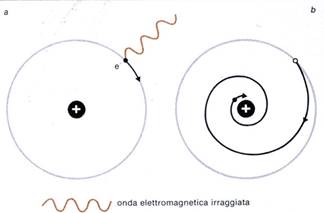 Quindi, nonostante il modello di Rutherford fosse molto seducente, soprattutto per la descrizione unitaria che dava della struttura del micro- e del macrocosmo, esso aveva il difetto di essere assolutamente incompatibile con le leggi classiche della meccanica e dell'elettrodinamica. Secondo queste leggi infatti, un corpo carico di elettricità che si muova con moto che non sia rettilineo ed uniforme, irradia energia a scapito della propria. L'elettrone pertanto, nel suo moto circolare intorno al nucleo, poiché è soggetto ad una continua accelerazione centripeta, e cambia quindi velocità ad ogni istante, dovrebbe irradiare e subire una progressiva diminuzione della propria energia. Ciò lo porterebbe a cadere, seguendo una traiettoria a spirale, sul nucleo. Si ricordi a questo proposito ciò che accadeva agli elettroni quando, urtando contro le pareti del tubo di scarica, emettevano radiazioni elettromagnetiche sotto forma di raggi X, proprio a seguito della decelerazione che subivano penetrando nel vetro.
Quindi, nonostante il modello di Rutherford fosse molto seducente, soprattutto per la descrizione unitaria che dava della struttura del micro- e del macrocosmo, esso aveva il difetto di essere assolutamente incompatibile con le leggi classiche della meccanica e dell'elettrodinamica. Secondo queste leggi infatti, un corpo carico di elettricità che si muova con moto che non sia rettilineo ed uniforme, irradia energia a scapito della propria. L'elettrone pertanto, nel suo moto circolare intorno al nucleo, poiché è soggetto ad una continua accelerazione centripeta, e cambia quindi velocità ad ogni istante, dovrebbe irradiare e subire una progressiva diminuzione della propria energia. Ciò lo porterebbe a cadere, seguendo una traiettoria a spirale, sul nucleo. Si ricordi a questo proposito ciò che accadeva agli elettroni quando, urtando contro le pareti del tubo di scarica, emettevano radiazioni elettromagnetiche sotto forma di raggi X, proprio a seguito della decelerazione che subivano penetrando nel vetro.
E' stato calcolato che l'atomo, se fosse costruito secondo il modello proposto da Rutherford, sarebbe destinato a disintegrarsi in una frazione di secondo. L'atomo, invece, per nostra fortuna, è stabile.
C'era, evidentemente, qualche cosa che non funzionava nel modello proposto da Rutherford: non rimaneva che cambiare modello, a meno che non si volesse cambiare le leggi della fisica.
Fonte: http://www.ianua.com/patrizia/scuola/file/chimica_inorg/atomo.doc
Sito web da visitare: http://www.ianua.com
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve