I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
LE LEGGI DEI GAS PERFETTI
I gas costituiscono i sistemi chimico-fisici più semplici da studiare. Infatti se sono sufficientemente lontani dalle condizioni di liquefazione e se sono sufficientemente rarefatti, tendono a comportarsi pressappoco allo stesso modo indipendentemente dalla specifica natura del gas considerato. Questa uniformità di comportamento dello stato gassoso ha permesso di postulare un ipotetico modello, detto gas ideale o perfetto nel quale si ipotizza che siano nulle le forze di interazione fra le sue molecole. Tali forze giocano invece un ruolo fondamentale nei cosiddetti stati condensati della materia (liquido e solido). Non esistendo alcun legame tra le molecole, esse sono libere, distanti tra loro, non possono interagire se non durante i brevissimi intervalli di tempo in cui si urtano. Un gas reale verifica queste condizioni se ha una bassa densità e, aggiungiamo, se è sufficientemente caldo e non troppo compresso così da essere lontano dal suo punto di liquefazione.
Per un gas ideale di massa m, massa molare M (g/mol) composto da N molecole e quindi n= N/No moli (No=numero di Avogadro) contenuto in un recipiente di volume V alla pressione P ed alla temperatura T, vale la seguente legge detta di stato dei gas perfetti:
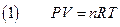
La R è detta costante universale dei gas. Se P viene espresso in Pascal e V in m3 si ha che:
R = 8.315 (Paxm3)/(molxK) =8.315Joule/molxK
Sottoponiamo ora un gas ad una trasformazione, ad esempio lo possiamo scaldare o comprimere. Se questo gas durante il nostro intervento non cambia composizione chimica e la sua massa e quindi le sue moli rimangono costanti, ricavando n dalla (1) si ottiene:
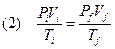
Consideriamo ora delle trasformazioni particolari.
TRASFORMAZIONE ISOTERMA (T=COST)
Se si mantiene costante la temperatura del gas, posso eliminare T dalla (2) e ottenere:
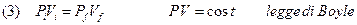
Oss 1: se rappresentiamo graficamente questa legge in un piano P-V, detto piano di Clapeyron si ottiene un ramo di iperbole equilatera. Ripetendo l’esperimento a varie temperature si ottengono altrettanto iperboli che risultano spostate sempre più verso l’alto col crescere della temperatura.
Oss2: Possiamo pensare la respirazione come un’applicazione delle leggi dei gas. Elevando la cassa toracica aumenta il volume della cavita’ e quindi diminuisce la pressione dell’aria all’interno: quando questa pressione diventa minore di quelle atmosferica, aria viene ispirata nei polmoni. Abbassando la cassa toracica, diminuisce il volume della cavita’ ed aumenta la pressione dell’aria all’interno: quando essa diventa maggiore della pressione atmosferica, aria viene ispirata dai polmoni.
TRASFORMAZIONE ISOBARA (P=COST)
Mantenendo costante la pressione del gas mentre questo subisce una trasformazione si ottiene, dividendo eliminando P dalla (2):
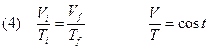
TRASFORMAZIONE ISOCORA (V=COST)
Mantenendo costante il volume del gas mentre questo subisce una trasformazione si ottiene, eliminando il volume dalla (2):
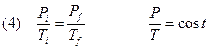
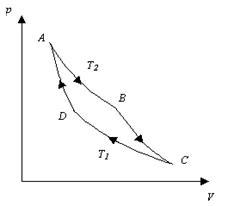
CICLO DI CARNOT
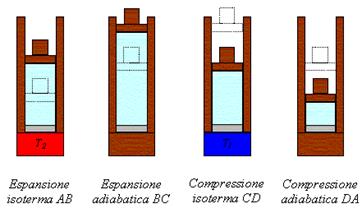
I motori dei mezzi di trasporto che usiamo tutti i giorni, durante il loro funzionamento, si comportano in modo simile alla seguente macchina termica “ideale”, che ha il massimo rendimento, il cui gas segue il cosiddetto ciclo di Carnot composto da due trasformazioni isoterme e da due adiabatiche, cioè da due trasformazioni che non scambiano calore con l’esterno perché avvengono troppo rapidamente. Durante le due isoterme avvengono gli scambi di calore con le sorgenti mentre con le due adiabatiche il gas viene condotto da una temperatura all’altra.
Fonte: http://www.fisicaweb.org/doc/termodinamica/equaz.stato%20facile.doc
Sito web da visitare: http://www.fisicaweb.org/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve