I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Il primo ragionevole modello atomico fu quello di Rutherford (1911): in base ad esso l'atomo viene assimilato ad un piccolo sistema planetario, in cui il nucleo, carico positivamente, si trova al centro mentre gli elettroni, particelle cariche negativamente, gli ruotano attorno compiendo orbite circolari. Consideriamo l'unico elettrone di massa m dell'atomo di idrogeno che ruota intorno al protone, l’unica particella del suo nucleo posta ad una distanza R. Un moto circolare uniforme richiede sempre la presenza di una forza centripeta. Nel caso dell’elettrone tale forza e’ quella attrattiva coulombiana. Indicando con e sia la carica dell'elettrone che quella del protone. Avremo:
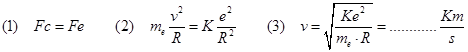
Studiamo ora il moto dell'elettrone attorno al nucleo soffermandoci in particolare sugli aspetti energetici di tale moto. Dato che l'elettrone si muove con velocità v, esso avrà un’energia cinetica :
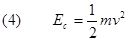 Se ora ricaviamo v2 dalla relazione (2)
Se ora ricaviamo v2 dalla relazione (2) 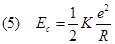 e lo sostituiamo nella (4) otteniamo:
e lo sostituiamo nella (4) otteniamo:
L'elettrone possiede anche un'energia potenziale elettrica data da:
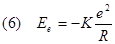
e quindi avrà un'energia totale data da:
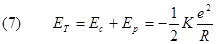
Oss 1: Dalla (7) deduciamo che l'energia totale dell'elettrone dipende, oltre che dalle cariche in gioco, anche dalla distanza R tra il nucleo e l'elettrone. La figura mostra l'andamento dell'energia totale in funzione di R:
|
Essendo negativa , l'energia totale aumenta al crescere di R (diventa meno negativa) e si annulla quando R diventa infinitamente. L'energia orbitale negativa di un elettrone indica che la sua energia cinetica è minore dell'energia potenziale elettrica e ciò gli impedisce di uscire dall'atomo. Per strappare l’elettrone dall’atomo occorre quindi un lavoro positivo: esso e’ detto energia di legame dell’elettrone. |
Oss2: La relazione (7) ottenuta applicando le leggi fisiche a noi note, chiamate "leggi classiche" porta a concludere che l'elettrone può avere un qualunque valore di energia, che dipenderà solo dalla sua distanza R dal nucleo. In altre parole, secondo questa relazione l'elettrone può percorrere qualsiasi orbita attorno al nucleo. Nel caso dei pianeti troviamo differenti orbite per i diversi pianeti ma l'esistenza di una certa orbita invece che un'altra è del tutto casuale, dipendente da come si è formato il Sistema Solare e tutto sarebbe in accordo con le leggi classiche se i raggi delle orbite dei pianeti avessero tutt'altro valore.
Agli inizi del nostro secolo ci si accorse che il modello dell'atomo di Rutherford, che possiamo sintetizzare analiticamente con la formula (7) ottenuta applicando le leggi della meccanica classica, fornisce dei risultati solo in parziale accordo con i dati sperimentali e, in qualche caso tale modello risulta del tutto inadeguato. Ad esempio, in base alle teorie classiche dell'elettromagnetismo, un elettrone che si muova su qualunque orbita dovrebbe, come fanno tutte le particelle cariche in moto accelerato, emettere onde elettromagnetiche (luce, raggi X, raggi infrarossi, onde radio). Questo fenomeno è presente nelle stazioni radiofoniche dove lungo le antenne trasmittenti vengono accelerati degli elettroni con la conseguente emissione di onde radio nello spazio circostante. Negli elettroni in orbita attorno al loro nucleo non si osserva nulla di ciò e, inoltre, se questo avvenisse, l'elettrone dovrebbe perdere rapidamente energia, diminuire pertanto la loro velocità ed alla fine cadere sul nucleo.
Questa situazione di notevole disagio fu risolta nel 1913 dal fisico danese Niels Bohr il quale affermò che non era corretto estendere le leggi classiche, valide per il mondo macroscopico (macrofisica, cioè quello da noi osservabile direttamente) , al mondo sub-atomico (microfisica), di dimensioni eccezionalmente più piccole.
In particolare, Bohr pensò che la causa del disaccordo tra teoria e realtà consistesse nell'aver attribuito agli elettroni una libertà infinita nel loro moto orbitale, così che essi potessero percorrere qualsiasi orbita intorno al nucleo. Egli stabilì nuove leggi che sono le basi della cosiddetta fisica quantistica fondata sulle seguenti ipotesi:
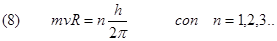
Calcoliamo il raggio delle orbite consentite di Bohr. Dalla (3) otteniamo:
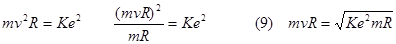
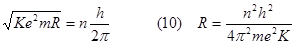 Combinando la (8) e la (9) otteniamo:
Combinando la (8) e la (9) otteniamo:
Possiamo riscrivere la (10) in modo più compatto come:
in cui la quantità rB chiamata raggio di Bohr può essere ricavata dalle costanti fondamentali presenti nell'equazione (10) ottenendo:
rB = 0.5310-10 m
Pertanto l'elettrone può ruotare attorno al nucleo soltanto su orbite i cui raggi siano multipli interi del raggio di Bohr, in particolare il raggio della prima orbita è pari a rB, il raggio della seconda orbita è 4 volte il raggio della prima cioè 4x0.5310-10=2.1210-10 m, il raggio della terza è 9 volte il raggio della prima.
L'atomo di idrogeno è il solo che soddisfi la condizione del problema affrontato da Bohr, perché possiede un solo elettrone. Ma lo ione dell'elio He+, formato da un atomo che ha perduto uno dei suoi due elettroni, viene ad avere la stessa costituzione dell'atomo di idrogeno con un nucleo positivo attorno al quale ruota un elettrone. La stessa cosa si può dire per il Litio ionizzato due volte, Li++, e in generale per gli atomi che hanno perso tutti gli elettroni salvo uno. Questi sistemi atomici vengono detti ioni idrogenoidi. Per essi è ancora valido il procedimento adottato da Bohr tenendo però presente che il loro nucleo ha una carica Ze. Pertanto i raggi delle loro orbite elettroniche valgono:
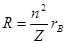
Osserviamo come i raggi delle orbite dell'elettrone per gli ioni idrogenoidi si restringono via via all'aumentare del numero atomico degli elementi perché risulta maggiore la forza attrattiva del nucleo.
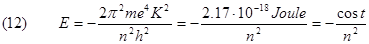
Per gli atomi idrogenoidi la (12) diventa:
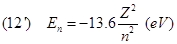
Anche l'energia dell'elettrone, così come avviene per i raggi delle sue orbite può possedere solo dei valori discreti, non continui chiamati livelli di energia definiti dal valore dell'intero n chiamato numero quantico.
Il valore della costante cioè -2.17x10-18J è il più basso valore dell'energia che può avere l'elettrone che possiede quando si trova nello stato con n=1 cioè sull'orbita più vicina al nucleo.
Poiché il valore dell'energia sopra indicato è molto piccolo, conviene utilizzare un sottomultiplo del Joule, adatto nel mondo microscopico, chiamato elettronvolt e così definito:
def: Un elettronvolt (eV) è l'energia corrispondente al lavoro richiesto per spostare una carica elementare e , (come quella dell'elettrone o del protone) attraverso un ddp di 1 Volt. Questa quantità di lavoro è data da: 1eV = L = qDV = 1.6x10-19Cx1J/C = 1.6x10-19 J
Con una semplice proporzione è immediato verificare che -2.17x10-18J = -13.6 eV.
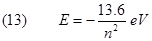 Pertanto avremo:
Pertanto avremo:
Dopo aver riordinato le idee! Parleremo di emissione ed assorbimento di energia sotto forma di onde elettromagnetiche
Abbiamo analizzato la prima legge di Bohr la quale afferma che l'elettrone può ruotare intorno al nucleo solo su orbite circolari il cui raggio è prestabilito ed è definito dalla relazione ( ). Poiché quando l'elettrone si muove su una di queste orbite (detto anche stato) non perde energia, l'orbita viene detta stazionaria, si parla quindi anche di stato stazionario. La seconda legge ha stabilito che l'energia totale posseduta dall'elettrone quando si muove su una delle orbite concesse è caratteristica dell'orbita stessa e vale (12 ). Le due formule dipendendo dal numero n che può assumere solo valori interi i raggi delle orbite e le energie non cambiano con continuità ma solo per valori discreti, si dice pertanto che l'orbita e l'energia associata all'elettrone è quantizzata. L'energia che un elettrone possiede in un determinato stato dell'atomo viene detta anche energia di legame dell'elettrone all'atomo relativa a quello stato. Normalmente l'elettrone occupa l'orbita con il più basso valore dell'energia cioè l'orbita caratterizzata dal numero quantico n = 1 che è quella più vicina al nucleo. L’elettrone può cambiare orbita soltanto se sono verificate le condizioni imposte dal seguente terzo postulato di Bohr:
Durante questo processo assorbirà o emetterà un fotone di frequenza f = E/h dove h è la costante di Planck. Quindi:
(15) hf = Ei-Ef
Es 1: Salto di un elettrone da un livello energetico più basso ad uno più alto: Se l'elettrone si trova nel suo livello energetico più basso (n=1) può saltare al secondo livello (n=2) assorbendo una quantità di energia E =E2-E1= = eV e tale energia gli è stata ceduta da un fotone di frequenza f =
Analogamente può saltare dal primo al terzo livello assorbendo una quantità di energia
Questi sono tipici processi di assorbimento dell’energia. Perciò se fotoni con un intervallo continuo di lunghezze d’onda emesso, ad esempio, da un corpo nero caldo attraversano un gas e poi vengono analizzati con uno spettroscopio, nello spettro continuo compare una serie di righe di assorbimento.
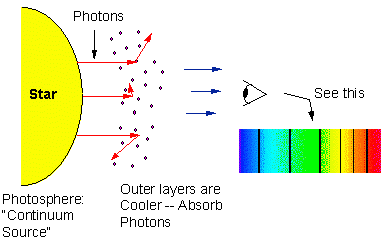
Tali righe scure di assorbimento si possono vedere nello spettro del Sole e delle stelle, dove sono dette righe di Fraunhofer, dal nome del loro scopritore. Esse sono dovute agli atomi che sono presenti nei più esterni e più freddi strati del Sole, che assorbono la radiazione proveniente dall’interno del Sole. La più interna e più calda parte del Sole emette uno spettro continuo di lunghezze d’onda, essendo troppo calda perché i singoli atomi possano conservare la loro struttura.
Es2: Rottura del legame che l'elettrone ha con il suo atomo: Se l'elettrone si trova nel suo livello energetico più basso può abbandonare l'atomo solo se assorbe un'energia uguale o maggiore a ; se si trova nel secondo livello può abbandonarlo solo se assorbe un'energia uguale o maggiore di eV
Es3: Salto di un elettrone da un livello energetico più alto ad uno più basso: Ciò può avvenire ovviamente soltanto se l'elettrone in precedenza si è trasferito al livello energetico più alto in seguito ad una adeguata assorbimento di energia ; nel tornare ai livelli inferiori l'elettrone emette un'onda elettromagnetica di energia pari alla differenza delle energie tra i due livelli. Così se l'elettrone passa, ad esempio, dal quarto al terzo livello emette un'onda elettromagnetica cioè un fotone di frequenza f = . Le corrispondenti righe spettrali sono dette righe di emissione. .
La formula di Ridberg-Ritz
Sostituendo la (12) nella (16) otteniamo:
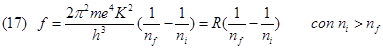
dove R è la costante di Rydberg e vale R=3,2898x1015 Hz
La (17) è nota anche come formula di Ridberg-Ritz scoperta in modo empirico prima che Bohr formulasse le sue leggi.
Per mezzo di questa equazione possiamo quindi calcolare la frequenza e pertanto la lunghezza d'onda corrispondente ad ogni transizione elettronica ed in tal modo controllare se la teoria di Bohr porta a risultati in accordo con i dati sperimentali cioè con le misure spettroscopiche. L'insieme delle transizioni a stati inferiori a partire da uno stato ni prende il nome di serie. Una serie di transizioni dà luogo ad uno spettro di righe.
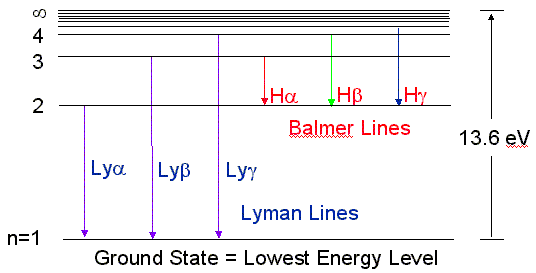
Ponendo nf=1 e ni=2,3,4..si ha la serie di righe spettrali detta di Lymann osservabile nell'UV
Ponendo nf=2 e ni=3,4,5..si ha la serie di righe spettrali detta di Balmer osservabile nel visibile
Ponendo nf=3 e ni=4,5,6..si ha la serie di righe spettrali detta di Paschen osservabile nell'IR vicino
Ponendo nf=4 e n=5,6,7,8 si ha la serie di righe detta di Brackett) osservabile nell’IR lontano
La frequenza f di solito non viene usata; si usa invece una grandezza ad essa proporzionale: il numero d'onda n che fornisce il numero di onde per unità di lunghezza d’onda, misurato perciò in l-1, e definito come:
(18) n = f/c = 1/l

Fonte: http://www.fisicaweb.org/doc/atomo/bohr.doc
Sito web da visitare: http://www.fisicaweb.org/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve