I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Le pile
Sono dispositivi capaci di trasformare energia chimica da una redox spontanea in energia elettromagnetica.
Nel 1796-99 A. Volta costruì le prime pile: consisteva in dischetti di Cu e Zn separati da dischetti di cotone o feltro imbevuti di H2O e NaCl. Problemi: perdita della soluzione acida e ossidazione dei dischetti di rame e zinco.
-Pila Daniell(1836, usata fino al 1866): è costituita da due semicelle in una delle quali è presente una soluzione di ZnSO4 e nell’altra CuSO4, a una concentrazione di molarità 1M(entrambi i Sali sono disocciato in ioni). In esse sono immersi due elettrodi, rispettivamente di Zn e Cu.
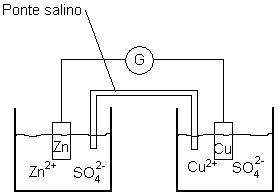 Ponte salino: è un tubo ad U contenente KCl che serve a mantenere la neutralità ionica delle due semicelle, poiché durante il funzionamento alcuni ioni aumentano o diminuiscono.
Ponte salino: è un tubo ad U contenente KCl che serve a mantenere la neutralità ionica delle due semicelle, poiché durante il funzionamento alcuni ioni aumentano o diminuiscono.
Quando chiudo il circuito osservo un aumento di volume dell’elettrodo di rame e una diminuzione di quello di zinco, poiché gli elettroni migrano dallo zinco, che si ossida, al rame che si riduce.
Anodo(-): ox Zn0→Zn2++2e-
Catodo(+): rid Cu2++2e-→Cu [questi si depositano sull’elettrodo di rame]
Reazione generale: Zn+Cu2+→Zn2++Cu
Diagramma di cella(è un modo abbreviato per scrivere le reazioni che avvengono all’interno delle celle): (-) Zn/Zn2+[prima reazione: anodo] || [ponte salino] Cu2+/Cu [reazione al catodo] (+) [in grassetto sono evidenziati gli elementi che sono presenti in ogni diagramma di cella]
Calcolo della forza elettromotrice di una pila: f.e.m.=E°catodo-E°anodo, dove E° sono i potenziali di riduzione standard. Per ottenere i potenziali di riduzione degli elementi i chimici hanno utilizzato un elettrodo di riferimento ad idrogeno, che veniva fatto gorgogliare su un elettrodo di platino.
In una pila Daniell F.e.m.=(0,34-(-0,76))V=1,1V
-Pile a secco: -celle primarie non ricaricabili]
-celle secondarie o accumulatori
Pila Leclanché (1866): pile stilo non alcaline, destinate ad un solo utilizzo, ma poco costose(f.e.m.= 1,5V). [Zn/MnO2]
Parte esterna Zn(anodo), che presenta una parte sporgente dal resto del cilindro di cui è costituita la pila. Catodo: impasto di MnO2, NH4Cl, e grafite finemente sminuzzata.
Catodo: (+) 2MnO2+2NH4+(aq)+2e-→Mn2O3+2NH3
Al termine avviene una reazione tra lo Zn2+ prodotto dall’ossido riduzione all’anodo e l’NH3 al catodo: Zn(NH3)42+.
C’è quindi un vantaggio nel costo, ma può esserci una perdita di materiale, inoltre tende a scaricarsi molto velocemente.
Pila alcalina(o pila alcalina a secco)
Sono sempre presenti Zn e MnO2, ma in questa sono immersi in un ambiente basico.
F.e.m.= 1,54 V, hanno una durata maggiore e tempi di resa più lunghi, poiché non si aggregano ioni intorno ai poli.
Pila Mallory(usata dopo le grandi guerre)
Attualmente si basano sulla reazione di ossido d’argento, Ag2O, ma prima veniva impiegato l’Hg, che venne in seguito ritenuto troppo pericoloso. È relativamente costosa in confronto quelle esaminate precedentemente. Anodo: Zn /Catodo: Ag2O/Elettrolita: KOH[che in soluzione si scinde negli ioni OH- e K+, che in questo caso è uno ione spettatore, cioè non interviene nelle reazioni].
Anodo(-): ox Zn0+2OH-→Zn2+(OH)2+2e-
Catodo(+): rid Ag2+O+H2O+2e-→2Ag+2OH-
-Celle secondarie[ricaricabili, per uso prolungato]
Durante la fase di ricarica le celle funzionano come celle elettrolitiche, ripristinando così le caratteristiche e le condizioni iniziali della pila, poiché attraverso la cessione di energia alle semicelle si ricrea una reazione non spontanea opposta a quelle di ossido riduzione che invece forniscono l’energia che produce la pila.
Intorno agli anni ’30 del Novecento venne prodotto il primo accumulatore, che però aveva un problema di smaltimento.
Consisteva in 6 cellule da 2V collegate in serie per dare una f.e.m. complessiva di 12V, in queste sono immerse delle placche rivestite da PbO2. L’elettrolita è costituita da una soluzione di H2SO4.
Anodo(-): ox Pb0(s)+HSO4-→PbSO4+H++2e-
Catodo(+): rid PbO2+3H++HSO4-+2e-→PbSO4+2H2O
Presenta alcuni problemi quali un peso elevato, inoltre a causa d’alcuni fori praticati sull’involucro c’è il rischio che possa uscire dell’H2SO4
Nichel - cadmio(NICAD):cella secondaria che produce una tensione di 1,4V
Anodo: rivestimento di cadmio su maglia di acciaio.
Catodo: supporto metallico con rivestimento poroso di Ni che trattiene l’Ni+4O2, offrendo un s molto ampio agli elettrodi e quindi liberando grandi quantità di energia.
Anodo(-): ox Cd0+2OH-→CdOH+2e-
Catodo(+): rid NiO2+2H2O+2e-→Ni(OH)2+2OH-
Può quindi essere ricaricata se s’invertono le reazioni, inoltre può venire sigillata per evitare le perdite. Hanno inoltre il vantaggio di essere ricaricate velocemente.
Per costruire una pila bisogna tener conto di alcuni parametri quali:
1) densità di energia:![]()
2)Energia specifica: ![]()
Nichel Idruro metallico – Litio
Celle secondarie simili a quelle precedenti, ma il reagente all’anodo è l’idrogeno, che è allo stato gassoso a temperatura ambiente. Catodo: NiO(OH), ossido basico di Nichel, con Ni di n.o. +3. Il vantaggio di questa pila è di poter immagazzinare il 50% in più→può far funzionare un apparecchio del 50% più a lungo.
Ha però il difetto di tendere a scaricarsi spontaneamente in modo piuttosto rapido.
Litio/Biossido di manganese
Il litio è estremamente leggero e facilmente ossidabile. Viene immerso in un mezzo acquoso perché altamente energetico. Ci sono solventi organici in grado di sciogliere in sali il Litio, come il carbonato di propilene e di o il perclorato di litio.
Anodo: Litio solido. Catodo: biossido di manganese trattato con grafite.
Genera una f.e.m. da 3,4 a 3,8V, questa batteria una quantità doppia di energia per a parità di peso.
Per un periodo di 7 anni non si scarica se non viene utilizzata.
Ione Litio: non ci sono fenomeni di ossidazione e riduzione, può trasferire gli ioni Litio da un elettrodo all’altro grazie all’elettrolita: si è infatti scoperto come questi ioni possano agevolmente attraversare i cristalli degli altri atomi.
Durante la scarica gli ioni litio migrano verso il catodo e gli elettroni migrano dalla parte opposta per controbilanciare la carica.
Invece, durante la ricarica, grazie all’applicazione di una differenza di potenziale si spostano gli elettroni: contemporaneamente e conseguentemente a quanto avvenuto gli ioni litio si sposteranno all’elettrodo opposto, quello di grafite.
1a generazione: elettrolita: esafloruro di litio e fosforo(LiPF6), 3,7V, con densità di energia doppia.
2a generazione: si utilizza una piccola pellicola di semiconduttore.
-Pila a combustibile
Sono come delle celle in cui i reagenti sono forniti continuamente, funzione quindi fino a che vengono alimentati. Venne già utilizzato durante le prima missioni spaziali.
Elettrolita: KHO, 200°C→si usano elettrodi porosi come catalizzatori, come il platino che serve appunto a facilitare la reazione.
Anodo(-)[ox H]: H2O+2OH-→2H2O++2e-
Catodo(+)[rid O]: O2+2H2O+4e-→4OH-
Ha alcuni vantaggi tra cui quello di produrre vapore acque come risultato delle reazioni, inoltre non si devono sostituire le sostanze degli elettrodi.
Efficienza termodinamica: le normali combustioni hanno normalmente un rendimento limitato, di circa il 35%/40% dell’energia prodotta, mentre qui abbiamo un rendimento il 75%, non inquinando nemmeno, poiché si produce H2O[Necar 5].
L’unico problema è rappresentato dalla difficoltà di reperire l’idrogeno e l’ossigeno in forma molecolare.
L’elettrolisi
È un processo realizzato per la prima volta nell’Ottocento, quando si riuscì a separare l’H dall’O, mediante una soluzione acquosa, poiché di per sé l’acqua è fin troppo poco ionizzata(circa 1 molecola ogni 107).
È un processo opposto a quello delle pile: in esse si utilizzava l’energia che si liberava da reazioni spontanee di ossido riduzione per produrre energia elettrica, mentre qui si utilizza energia elettrica per far avvenire redox non spontanee[Per gli accumulatori infatti si dice che durante la scarica si comportano come celle galvaniche, mentre durante la carica come delle celle elettrolitiche].
Da ciò si evince la principale differenza tra i due processi: l’uso di reazioni non spontanee.
Cloruro di sodio fuso: processo industriale chiamato “Processo Downs” che serve a produrre Sodio metallico ad una temperatura t>800°C(t. di fusione dell’NaCl). Si immergono due elettrodi di un elemento refrattario resistente al calore, in una vasca contenente.
Anodo: grafite, Catodo: acciaio;
Anodo(+)[Cl]: 2Cl--2e-→Cl2 , gorgoglio di cloro gassoso
Catodo(-)[Na]: 2Na++2e-→2Na , sodio metallico.
Processi simili avvengono per produrre Magnesio dal cloruro e così anche per tutti i metalli alcalini egli alcalino-terrosi.
Si può far avvenire un’elettrolisi partendo da NaCl in soluzione acquosa, a cui si devono aggiungere tracce di ioni H3O+ od OH-. Al catodo si scompone l’acqua conformemente ai criteri di riduzione standard: Catodo(-)[H2O]: 2H2O+2e-→2H2+2OH-
Anodo: ossidazione del cloro: (+)[Cl]: 2Cl-→Cl2+2e-
Ma non si può ricavare sodio metallico che rimane in forma ionica,, produce solo H, Cl e anche NaOH, se si fa evaporare l’acqua.
Elettrolisi dell’acqua: soluzione acquosa di H2SO4, per condurre la corrente:
Voltmetro di Hoffmann: Catodo(-)[rid H]: 4H2O+4e-→2H2+4OH-
Anodo: (+) [ox O] 6 H2O→4 H3O++O2+4e-
Applicazioni industriali:
1)Raffinazione dei metalli: Consiste in processi elettrolitici, in cui l’anodo è costituito dal metallo da sottoporre a raffinazione, immerso in una soluzione di un suo sale, che passerà quindi in soluzione e gli ioni metallici si depositano in forma pura[Cu, Ag, Au, Se].
2)Galvanostegia: processi di copertura dei metalli con superfici sottili di un altro metallo che serve generalmente ad una funzione protettiva, per esempio nei metalli che si ossidano facilmente al contatto con l’aria, oppure a ricoprirlo con un metallo più nobile.
Es.: se serve ricoprire un cucchiaio con una lamina d’argento, si dovrà posizionare l’oggetto al catodo, e usare come elettrolita il nitrato di argento, quindi si chiude il circuito. L’Ag passa in soluzione, così gli ioni positivi si fisseranno sul catodo, ricoprendolo con un sottile strato.
Per ricoprire con una lamina d’oro di norma si utilizza del cloruro d’oro.
Per la protezione di norma si effettuano dei processi di stagnatura, zincatura, nichelatura o cromatura, poiché un sottile strato di questi metalli permette, al Fe, di non ossidarsi.
3)Galvanoplastica: processo del tutto simile al precedente con la differenza che si ricoprono oggetti non composti da metalli, che per far sì che avvenga il processo elettrolitico, mediante un passaggio di corrente vengono generalmente ricoperti con polvere di grafite.
Fonte: https://wiki-wiki-learn.wikispaces.com/file/view/Pile+e+Elettrolisi.doc
Sito web da visitare: https://wiki-wiki-learn.wikispaces.com
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve