I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Risposte
a) 47; 60 b) N = A – Z = 70 – 32 = 38 c) ![]()
d) A = 60 e) 10 f) si, N = A – Z = 65 – 29 = 66 – 30 = 36
g) no, 40 ¹ 45 h) 19; 21 i) si, Z = 12
j) 18 k) 32 l) N = A – Z = 92 – 42 = 50
m) Z = 29 n) no, hanno medesimo A = 78 o) A = 123 = numero nucleoni
p) no, hanno medesimo A = 32 (isobari) q) Z = 17 r) ![]()
s) ![]() t) si, N = A – Z = 23 – 11 = 24 – 12 = 12
t) si, N = A – Z = 23 – 11 = 24 – 12 = 12
Determinare il peso atomico relativo (approssimato alla 1a cifra decimale) dei seguenti elementi di cui sono fornite, tra parentesi, le abbondanze isotopiche percentuali.
2. HNO3 + HCl → NO + Cl2 + H2O Dopo aver bilanciato la precedente reazione determinare
Risposte
1.a ![]()
![]()
1.b ![]()
![]()
1.c ![]()
![]()
2.a ![]()
![]()
2.b ![]()
![]()
2.c ![]()
![]()
2.d ![]()
![]()
3.a ![]()
![]()
3.b ![]()
![]()
3.c ![]()
![]()
3.d ![]()
![]()
Dopo aver bilanciato le reazioni rispondere ai quesiti proposti
1. Quanti grammi di H2 vengono prodotti dalla reazione tra 11,5 grammi di Na ed acqua in eccesso? La reazione (da bilanciare) è: Na + H2O → NaOH + H2
2. Un eccesso di Azoto reagisce con 2 g di Idrogeno. Quanti grammi di Ammoniaca vengono prodotti? La reazione (da bilanciare) è: N2 + H2 → NH3
3. Quanti grammi di Ossigeno vengono richiesti per bruciare completamente 85,6 grammi di Carbonio? E quanti grammi di CO2 si formeranno? La reazione (da bilanciare) è: C + O2 → CO2
4. H2SO4 + Al(OH)3 → Al2(SO4)3 + H2O Dopo aver bilanciato, calcolare quanto Idrossido di Alluminio Al(OH)3 e' necessario per far reagire completamente 15 g di Acido Solforico H2SO4? Quanto Solfato di Alluminio Al2(SO4)3 si formerà da tale reazione?
5. HI + Mg(OH)2 → MgI2 + H2O Dopo aver bilanciato, calcolare quanto Ioduro di Magnesio MgI2 si produce facendo reagire 30 g di Acido Iodidrico HI con 40 g di Idrossido di Magnesio Mg(OH)2. Quale dei due reagenti rimane senza aver reagito completamente alla fine della reazione e in che quantità?
6. H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O Dopo aver bilanciato, calcolare quanti grammi di Acido Ortofosforico H3PO4 sono richiesti per reagire completamente con 75 g di Idrossido di Calcio Ca(OH)2. Quanto Ca3(PO4)2 si forma da tale reazione?
7. P + O2 → P2O5 Dopo aver bilanciato, calcolare quanto Fosforo P e quanto Ossigeno O2 sono necessari per produrre 1000 grammi di Anidride Fosforica P2O5. Se facessimo reagire 500 grammi di Fosforo con 500 grammi di Ossigeno, quanta Anidride Fosforica si otterrebbe?
8. ZnS + O2 → ZnO + SO2 Dopo aver bilanciato, calcolare quanti grammi di ossido di zinco si formano per forte riscaldamento in aria di 1 kg di ZnS.
9. Al + Cr2O3 → Al2O3 + Cr Dopo aver bilanciato, calcolare quanto cromo metallico si può ottenere da una miscela di 5 kg di alluminio e di 20 kg di ossido cromico e quale reagente resta alla fine della reazione e in che quantità.
10. Quanti chilogrammi di acido solforico (H2SO4) possono essere preparati da un chilogrammo di minerale cuprite (Cu2S), se ciascun atomo di zolfo della cuprite viene convertito in una molecola di acido?
11. Quando il rame Cu è riscaldato con un eccesso di zolfo S si forma Cu2S. Calcolare quanti grammi di solfuro rameico Cu2S possono essere prodotti da 100 g di rame riscaldato con 50 g di zolfo, che reagente rimane alla fine della reazione e in che quantità.
12. Il biossido di manganese può essere trasformato in manganato di potassio (K2MnO4) e successivamente in permanganato (KMnO4) secondo le seguenti reazioni:
MnO2 + KOH + O2 → K2MnO4 + H2O
K2MnO4 + CO2 + H2O → KMnO4 + KHCO3 + MnO2
dopo aver bilanciato, calcolare quanto ossigeno è necessario per preparare 100 g di permanganato di potassio.
13. Quanti grammi di ossigeno O2 sono richiesti per ossidare completamente 85,6 g di carbonio C ad anidride carbonica CO2 ? Quante moli di CO2 si formano? Quanto ossigeno è necessario per ossidare la stessa quantità di carbonio ad ossido di carbonio CO? Quante moli di CO si formano?
14. Nella decomposizione del clorato di potassio (KClO3) in ossigeno (O2) e cloruro di potassio (KCl) si formano 64,2 g di ossigeno. Dopo aver bilanciato, calcolare quanti grammi di cloruro di potassio vengono prodotti.
15. Mg(OH)2 + HNO2 → Mg(NO2)2 + H2O Dopo aver bilanciato, calcolare quanti grammi di Mg(NO2)2 si otterranno, disponendo di 8,2 g di idrossido di magnesio (Mg(OH)2) e di acido nitroso (HNO2) in eccesso.
16. NaIO3 + NaHSO3 → NaHSO4 + Na2SO4 + H2O + I2 Dopo aver bilanciato, calcolare quanto iodato (NaIO3) e quanto bisolfito (NaHSO3) sono necessari per produrre 1 kg di I2.
17. Fe + O2 → Fe2O3 Dopo aver bilanciato, calcolare che massa di ossido ferrico (Fe2O3) può essere ottenuta per completa ossidazione di 100 g di ferro.
18. Quanti grammi di acido solforico (H2SO4) possono essere ottenuti da 1 Kg di pirite (FeS2) secondo le seguenti reazioni (da bilanciare):
FeS2 + O2 → Fe2O3 + SO2
SO2 + O2 → SO3
SO3 + H2O → H2SO4
19. Una miscela di 100 g di H2 e 100 g di O2 è sottoposta ad una scarica elettrica in modo che si formi acqua. Calcolare quanti grammi di acqua si producono.
20. Il perclorato di potassio (KClO4) può essere ottenuto attraverso la seguente serie di reazioni (da bilanciare):
Cl2 + KOH → KCl + KClO + H2O
KClO → KCl + KClO3
KClO3 → KClO4 + KCl
Calcolare quanti grammi di Cl2 sono necessari per preparare 100 g di perclorato.
21. Dopo aver bilanciato la seguente reazione CaH2 + H2O → Ca(OH)2 + H2 calcolare quanti grammi di idrogeno possono essere prodotti da 50 g di idruro (CaH2).
22. Bi + HNO3 + H2O → Bi(NO3)3.5H2O + NO Dopo aver bilanciato calcolare quanti grammi di nitrato di bismuto pentaidrato Bi(NO3)3.5H2O si possono formare da 10,4 g di bismuto
23. Il solfuro di carbonio può essere prodotto dalla seguente reazione: C + SO2 → CS2 + CO Dopo aver bilanciato, calcolare quanto solfuro (CS2) si può produrre da 450 kg di anidride solforosa (SO2).
24. L'acido azotidrico (HN3) può essere preparato attraverso la seguente serie di reazioni:
N2 + 3H2 → 2NH3
4NH3 + Cl2 → N2H4 + 2NH4Cl
4NH3 + 5O2 → 4NO + 6H2O
2NO + O2 → 2NO2
2NO2 + 2KOH → KNO2 + KNO3 + H2O
2KNO2 + H2SO4 → K2SO4 + 2HNO2
N2H4 + HNO2 → HN3 + 2H2O
Calcolare quanto idrogeno H2 e quanto cloro Cl2 sono necessari per preparare 100 g di acido azotidrico.
25. Date le seguenti reazioni (da bilanciare):
Pb + HNO3 → Pb(NO3)2 + H2
Ag2O + HNO3 → AgNO3 + H2O
Bi(OH)3 + HNO3 → Bi(NO3)3 + H2O
Calcolare quanti grammi di acido nitrico (HNO3) è necessario impiegare nei tre casi volendo ottenere in ciascuno di essi 200 g di sale, rispettivamente Pb(NO3)2, AgNO3 e Bi(NO3)3.
26. Il bicromato di potassio (K2Cr2O7) ossida l'acido solfidrico (H2S) a zolfo elementare (S) in ambiente acido secondo la seguente reazione K2Cr2O7 + H2S + HCl → CrCl3 + KCl + S + H2O
Dopo aver bilanciato, calcolare quanti grammi di bicromato sono necessari ad ossidare 15 g di acido solfidrico e quanto cloruro cromico (CrCl3) si forma.
27. Data la reazione (da bilanciare) BaCl2 + H2SO4 → BaSO4¯ + HCl calcolare quanti grammi di solfato (BaSO4) si formano facendo reagire 500 g di cloruro (BaCl2) con 100 g di acido solforico (H2SO4). Calcolare inoltre quale dei due reagenti non reagisce completamente ed in che quantità si trova al termine della reazione.
28. Data la reazione (da bilanciare) MgCl2 + AgNO3 → AgCl¯ + Mg(NO3)2 calcolare quanti grammi di cloruro di argento (2AgCl) e di nitrato di magnesio (Mg(NO3)2) si formano facendo reagire 150 g di cloruro di magnesio (MgCl2). Calcolare inoltre quanti grammi di nitrato di argento (AgNO3) vengono consumati.
29. Ad una soluzione contenente 40 g di cloruro di bario BaCl2 vengono aggiunti 50 g di nitrato di argento AgNO3. Calcolare quanti grammi di cloruro di argento AgCl precipitano e quanti grammi di cloruro di bario rimangono in soluzione. BaCl2 + AgNO3 → AgCl + Ba(NO3)2
30. Dopo aver bilanciato le seguenti reazioni:
Cl2 + KOH → KCl + KClO + H2O
KClO → KCl + KClO3
calcolare quanti grammi di cloro (Cl2) sono necessari per preparare 250 g di clorato di potassio (KClO3).
C6H12O6 → CH3CH2OH + CO2
Calcolare quanti grammi di zucchero sono necessari per produrre 1000 g di alcool etilico e quante moli di anidride carbonica si generano.
Calcolare quante moli di idrogeno si formano. Calcolare inoltre quale dei due reagenti è presente in eccesso e quante moli rimangono senza aver reagito alla fine della reazione.
La reazione (da bilanciare) è la seguente Al + HCl → H2 + AlCl3
Risposte
1. (2,2-2,1) 0,5g 2. (1,3-2) 11,3g 3. (1,1-1) 228,1g 313,7g
4. (3,2-1,6) 8,0g 17,4g 5. (2,1-1,2) 32,6g 33,2g Mg(OH)2 6. (2,3-1,6) 66,1 g 104,7g
7. (4,5-2) 436,4 g 563,6g 887,2g 8. (2,3-2,2) 835g 9. (2,1-1,2) 9.635g 5.917g Cr2O3
10. 616,2g 11.125,2g 24,8g S 12. (2,4,1-2,2) (3,4,2-2,4,1) 15,2g
13. 228,1g 7,13mol 114,0g 7,13mol 14. (2-3,2) 99,7g 15. (1,2-1,2) 16,4 g
16. (2,5-3,2,1,1) 1,56 kg 2,05 kg 17. (4,3-2) 143,0g 18. (4,11-2,8) (2,1-2) (1,1-1) 1,635 kg
19. (2,1-2) 112,6g 20.(1,2-1,1,1)(3-2,1)(4-3,1)204,7g21. (1,2-1,2) 4,8g
22. (1,4,3-1,1) 24,1g 23. (5,2-1,4) 267,4g 24. 42,2g 164,8g
25. 76,1g 74,2g 95,7g 26. (1,3,8-2,2,3,7) 43,2g 46,5g 27.(1,1-1,2) 238,0g 287,7g BaCl2
28. (1,2-2,1) 535,3g 451,6g 233,7g 29. (1,2-2,1) 42,2g 9,4g 30. (1,2-1,1,1) (3-2,1) 433,9g
31. (1-2,2) 1955,3g 21,7 mol 32. (2,6-3,2) 2 mol H2 0,17 mol Al
Date le seguenti composizioni percentuali (in massa), determinare le corrispondenti formule minime
1) 3,09% H 31,60% P 65,31% O 2) 75,27% Sb 24,73% O
3) 75,92% C 6,37% H 17,71% N 4) 44,87% K 18,39% S 36,73%O
Determinare la composizione percentuale dei seguenti composti
5) Fe2O3 6) CaO 7) Mg(NO3)2 8) Na2SO4 9) NH4HCO3 10) C6H12O6
Determinare la formula molecolare delle seguenti sostanze di cui si conosce il peso molecolare e i risultati dell’analisi quantitativa, espressi come massa dei singoli elementi costituenti il campione analizzato
11) Pr = 34,01 u 20,74 g H 329,6g O
12) Pr = 30,07 u 99,86 g C 25,14g H
13) Pr = 176,12 u 8,18 mg C 0,92 mg H 10,90 mg O
14) Pr = 194,19 u 247,40 mg C 25,95 mg H 144,26 mg N 82,39 mg O
15) Pr = 162,23 u 59,23 mg C 6,96 mg H 13,81 mg N
Risposte
1) H3PO4 2) Sb2O5 3) C5H5N 4) K2SO4 5) 70% Fe 30%O 6) 71,5% Ca 28,5% O
7) 16,4% Mg 18,9% N 64,7% O 8) 32,4% Na 22,6% S 45,0% O
9) 17,7%N 6,4% H 15,2% C 60,7% O 10) 40,0% C 6,7% H 53,3% O
11) H2O2 12) C2H6 13) C6H8O6 (ac. Ascorbico - vit.C) 14) C8H10N4O2 (caffeina) 15) C10H14N2 (nicotina)
Negli ultimi decenni dell'Ottocento la maggior parte degli scienziati aderiva alla teoria atomica, ma i dati sperimentali che si andavano accumulando suggerivano l’idea che l’atomo non fosse in realtà il costituente ultimo della materia, ma che possedesse una struttura interna costituita di particelle elettricamente cariche. Al fine di descrivere e giustificare in modo adeguato le nuove caratteristiche che si evidenziavano a livello subatomico vennero creati, nei primi anni del ‘900, diversi modelli atomici.
I primi indizi sull’esistenza di una struttura interna dell’atomo si ebbero con la scoperta dell’elettrone e la constatazione che tale particella poteva essere estratta da qualsiasi tipo di atomo e doveva pertanto essere considerata un costituente comune di tutti gli atomi.
La scoperta dell'elettrone avvenne grazie ad una serie di esperimenti condotti durante gran parte dell'Ottocento sulla conduzione elettrica attraverso i gas rarefatti.
Fin dal 1838 Faradayaveva osservato, effettuando esperienze di scariche elettriche in atmosfera gassosa rarefatta, strani fenomeni, quali striature, spazi oscuri, senza peraltro essere in gradi di interpretarli. Nel 1858 J. Plückerebbe l'idea, in seguito rivelatasi estremamente proficua, di avvicinare un magnete alla scarica per verificarne gli effetti. Non vide nulla di interessante poiché il vuoto non era sufficientemente spinto. Nel 1869 J.W.Hittorfriuscì ad ottenere dentro i tubi di scarica un vuoto migliore e cominciò a vedere quelli che noi oggi chiamiamo raggi catodici.
L'apparecchiatura utilizzata, ideata da Crookes (tubo di Crookes o tubo di scarica), è costituita da un tubo di vetro alle cui estremità sono saldati due elettrodi metallici collegati con un generatore di corrente continua con una differenza di potenziale di circa 10.000 volts. All'interno l'aria viene sostituita con un gas qualsiasi.
Si collega il tubo con una pompa del vuoto che fa diminuire gradatamente la pressione interna. Finché la pressione è superiore a 0,4 atm tra i due elettrodi si producono normali scariche elettriche, del tutto simili ai fulmini atmosferici.
Al di sotto di tale valore la scintilla scompare per lasciare il posto ad una luminosità diffusa che, a pressioni di circa 10-6 atm, interessa via via tutto il gas. In queste condizioni il vetro di fronte al catodo emette una debole luminescenza (fluorescenza).
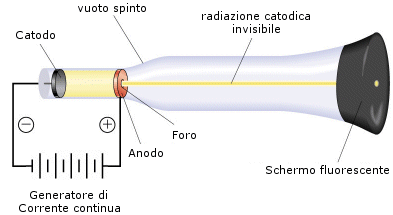
Tale fenomeno fu messo in relazione con possibili radiazioni che potevano essere prodotte dal catodo e che Goldstein in seguito chiamò raggi catodici.
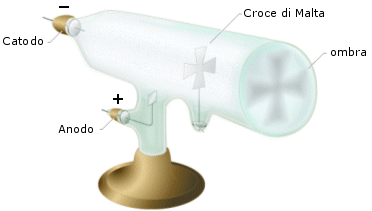
Oggi si sa che si tratta di elettroni che vanno dal catodo all'anodo rendendo la parete che colpiscono fluorescente, ma allora non si sapeva se si trattasse di radiazioni luminose o corpuscolari. Si sapeva solo che si propagavano in linea retta dal polo negativo a quello positivo. Infatti un oggetto metallico frapposto sul loro cammino proiettava nettamente la sua ombra.
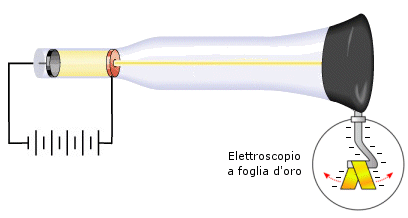
Nel 1895 finalmente, Perrin, osservando che un elettroscopio copito dalla radiazione catodica si elettrizzava negativamente, dimostrò che i raggi emessi dal catodo erano dotati di carica negativa.
Altri esperimenti condotti sui raggi catodici dimostrarono che doveva trattarsi di particelle (lo stesso Crookes aveva trovato che i raggi catodici erano in grado di mettere in rotazione, colpendola, una minuscola ruota a pale, interposta sul loro cammino).

D’altra parte l’idea che anche l’elettricità potesse avere una struttura particellare non era nuova, essendo già stata avanzata dal fisico tedesco H.L. Helmholtz (1881), il quale aveva suggerito che, se la materia aveva una struttura discontinua, formata cioè da particelle (atomi e molecole), allora era necessario fare la stessa ipotesi anche per l'elettricità.
Solo ipotizzando l’esistenza di atomi di elettricità potevano essere infatti facilmente interpretate le leggi dell'elettrolisi scoperte da Faraday quasi mezzo secolo prima, secondo le quali vi è una proporzionalità rigorosa tra la quantità di materia che viene decomposta dal passaggio di una corrente elettrica e la quantità di corrente elettrica utilizzata.
In pratica si poteva pensare che per decomporre un certo numero di particelle di materia fosse sempre necessario un certo numero di particelle di elettricità.
Esperienza di Thomson
A) Un campo magnetico di intensità H devia una particella in movimento ed elettricamente carica con una forza perpendicolare al vettore velocità.
Applicando ad un tubo di Crookes un campo magnetico di intensità H, perpendicolare al moto della radiazione catodica, gli elettroni, aventi carica e e velocità v, sono sottoposti ad una forza F = Hev che li costringe a muoversi, all’interno del campo, lungo una traiettoria circolare di raggio r. Il valore di r può essere calcolato sulla base della posizione assunta dal punto fluorescente sullo schermo di ZnZ, rispetto alla direzione rettilinea. Poiché F = ma e l’accelerazione centripeta vale a = v2/r, possiamo scrivere
B) Applicando ad un tubo di Crookes un campo elettrico di intensità E, gli elettroni di carica e vengono deviati verso il polo positivo con una forza F = Ee. La forza elettrica risulta sempre perpendicolare alle armature del condensatore e quindi gli elettroni assumono una traiettoria parabolica nel tratto di campo elettrico attraversato.
C) Se ora sottoponiamo il flusso di elettroni contemporaneamente ai due campi di cui regoliamo opportunamente l’intensità in modo che il loro effetto totale sia nullo e gli elettroni si muovano in linea retta, la forza elettrica eguaglierà la forza magnetica
Sostituendo il valore della velocità v così trovato nella relazione
|
L’idea che gli elettroni rappresentassero un costituente fondamentale, comune a tutti gli atomi, venne definitivamente avvalorata dalla determinazione da parte di Thomson (1897) del rapporto carica/massa (e/m) dell’elettrone.
Il valore così trovato è infatti uguale per tutti gli elettroni e non cambia se si sostituisce il tipo di materia che forma il catodo emittente e il gas presente nell'apparecchiatura.
Tale valore risultava quasi 2000 volte maggiore del corrispondente valore e/m tra carica e massa dello ione idrogeno, misurato tramite elettrolisi. Se supponiamo che la carica e dell'elettrone sia uguale e contraria a quella dello ione idrogeno (al fine di garantire la neutralità dell'atomo di idrogeno), il rapporto tra i due valori diventa automaticamente un rapporto tra masse. Le particelle che formavano i raggi catodici risultarono così sorprendentemente possedere una massa quasi 2000 volte inferiore a quella del più piccolo atomo conosciuto. Si cominciò dunque a ritenere plausibile l'ipotesi che gli atomi non rappresentassero il gradino ultimo della materia, ma potessero anch'essi essere composti di particelle più piccole.
Nell'articolo pubblicato su "Philosophical Magazine", Thomson afferma: "Così, sotto questo aspetto, nei raggi catodici abbiamo la materia in uno stato nuovo, uno stato in cui la suddivisione è spinta molto più in là che nel normale stato gassoso, uno stato in cui tutta la materia, cioè la materia derivante da fonti diverse come l'Ossigeno, l'Idrogeno etc. è di un unico tipo, essendo essa la sostanza di cui sono costituiti tutti gli elementi chimici." L'atomo perde per la prima volta la sua indivisibilità e l'elettrone diventa momentaneamente la sostanza prima.
Nel 1905 Millikan dimostrò che la carica elettrica è sempre un multiplo intero di una quantità elementare pari 1,602 10-19 Coulomb, carica che si dimostrò appartenere sia al protone che all'elettrone . Nota la carica dell'elettrone ed il rapporto e/m fu quindi possibile ricavare il valore assoluto della massa dell'elettrone .
Esperimento di Millikan
Minutissime goccioline d’olio, caricate negativamente con una carica incognita q mediante irradiazione con raggi X, vengono immesse tra le armature di un condensatore che produce un campo elettrico di intensità E. Ciascuna gocciolina è sottoposta ad una forza elettrica Fe = Eq ed alla forza peso Fp = mg. Variando opportunamente l’intensità E del campo elettrico è possibile variare la forza elettrica, per una goccia, fino a renderla uguale alla sua forza peso (la goccia rimarrà sospesa in equilibrio). Eq = mg Misurando il diametro della goccia e conoscendo la densità dell’olio, si può calcolare la massa m della goccia. L’unica incognita rimane perciò la carica q, che viene in tal modo misurata. Tale carica risulta essere, per tutte le gocce, un multiplo intero di 1,6 10-19 C, valore che viene assunto come carica elettrica elementare ed associato alla carica dell’elettrone. |
|
il nome è stato coniato da G.Johnstone Stoney nel 1894
1,758 820 150 .108 C/g
9,578 833 92 .104 C/g
1,602 176 487 .10-19 C
9,109 382 15 .10-28 g
Il fatto che un atomo neutro contenesse al suo interno particelle negative di massa trascurabile rispetto a quella dell’intero atomo, richiedeva naturalmente la presenza di una controparte positiva alla quale associare la maggior parte delle sua massa.
Nel 1886 Goldstein, usando un tubo a raggi catodici con catodo forato, rilevò dietro al catodo, una luminescenza provocata da radiazioni con movimento opposto a quello dei raggi catodici.. Egli dimostrò che si trattava di particelle cariche positivamente (raggi canale). Poiché la massa di tali particelle era diversa a seconda del gas contenuto nel tubo, si ritenne, correttamente,. che gli elettroni che attraversavano il gas, accelerati dalla differenza di potenziale, fossero in grado, urtandoli, di strappare gli elettroni contenuti negli atomi del gas, trasformandoli così in ioni positivi.
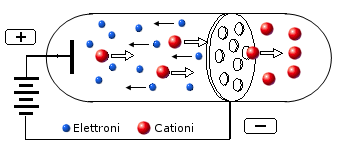
I cationi generati, attirati dal catodo, andavano a formare i raggi canale. Si dimostrava dunque che l’atomo ormata da particelle negative di piccola massa (elettroni) che neutralizzavano una porzione positiva più massiccia.
Lo studio dei raggi canale portò in seguito lo stesso Thomson nel 1907 a scoprire l'esistenza degli isotopi. Sottoponendo i raggi canale a condizioni sperimentali simili a quelle a cui aveva sottoposto gli elettroni per determinarne il rapporto e/m, Thomson scoprì che gli ioni di uno stesso elemento non si distribuivano su di un'unica parabola, ma presentavano diverse traiettorie. Thomson interpretò correttamente i risultati dell'esperimento ipotizzando che all'interno di uno stesso elemento fossero presenti gruppi di atomi aventi le stesse caratteristiche chimiche, ma massa diversa. Erano stati scoperti gli isotopi. Lo strumento utilizzato da Thomson è sostanzialmente analogo all'attuale spettrografo di massa che permette oggi di pesare le sostanze chimiche, calcolando inoltre le percentuali relative dei vari isotopi in base all'annerimento relativo della lastra fotografica che vanno a colpire.
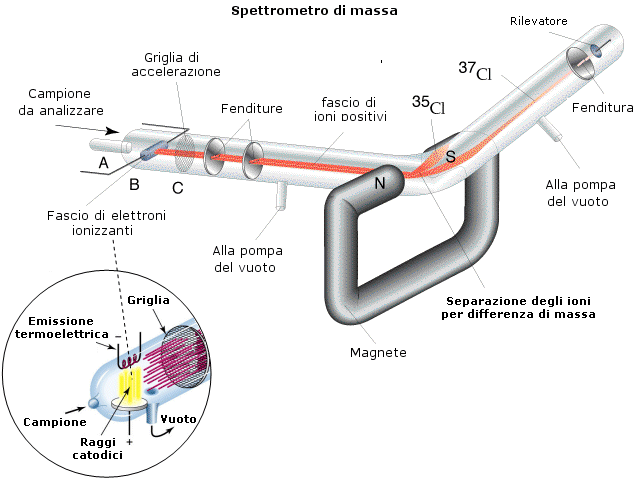
L'ipotesi di Prout (1815) secondo la quale gli atomi degli elementi più pesanti erano costituiti da un diverso numero di atomi di Idrogeno (protone), veniva dunque sostanzialmente confermata. In effetti rimanevano però alcune discrepanze apparentemente inspiegabili.
Se prendiamo ad esempio il Carbonio 12, il cui nucleo è composto da 6 protoni e 6 neutroni troviamo che la sua massa complessiva (12 u) è minore della somma delle masse dei suoi nucleoni presi singolarmente. (6.(1,0073 u) + 6.(1,0087 u) = 12,096 u). Tale apparente contraddizione si spiega ammettendo che una parte della massa dei neutroni e dei protoni si sia trasformata in energia di legame, secondo la relazione einsteniana E = mc2, necessaria a tenerli uniti all'interno del nucleo. Tale quantità è chiamata difetto di massa.
Nel 1896 Henri Becquerel scoprì casualmente la radioattività dell'Uranio. Le sue ricerche vennero proseguite dai coniugi Curie e poi da Rutherford, il quale per primo nel 1898 riconosce le radiazioni da lui chiamate (alfa) e (beta), emesse da elementi radioattivi.
Ben presto risulta chiaro che le radiazioni beta sono costituite da elettroni come i raggi catodici, mentre per lungo tempo resta oscura la natura delle radiazioni alfa.
Pochi anni più tardi P. Villard in Francia scoprì che tra le radiazioni emesse da una sostanza radioattiva ve ne sono di un terzo tipo, chiamate (gamma), che si riconoscono simili ai raggi X.

Bisogna aspettare il 1904 perché Rutherford dimostri che la radiazione alfa è costituita da nuclei di Elio. Lo stesso Rutherford, con la collaborazione di Soddy, fu in grado ben presto di dimostrare che durante l'emissione delle radiazioni alfa e beta, l'elemento radioattivo si trasforma, con un ritmo caratteristico, in un elemento di peso e numero atomico diverso (e quindi in un altro elemento chimico).
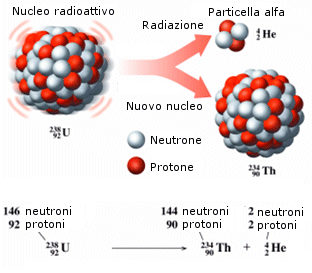
Decadimento alfa - Quando un nucleo radioattivo (e quindi instabile) emette una radiazione , esso si trasforma, o decade, nell'elemento che lo precede di due posti nella tabella periodica, a causa della perdita di due protoni (e due neutroni).
![]()
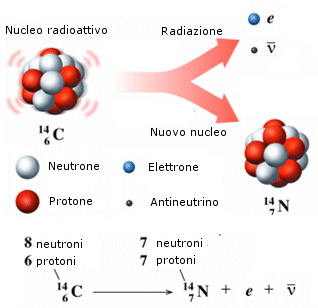
Decadimento b- (beta-meno) Quando un nucleo radioattivo emette una radiazione -, esso si trasforma, o decade, nell'elemento che lo segue di un posto nella tabella periodica, a causa della trasformazione di un neutrone del suo nucleo in un protone (che rimane nel nucleo), un elettrone e un antineutrino (che si allontanano dal nucleo).
![]()
![]()
Decadimento b+ (beta-più) Quando un nucleo radioattivo emette una radiazione +, esso si trasforma, o decade, nell'elemento che lo precede di un posto nella tabella periodica, a causa della trasformazione di un protone del suo nucleo in un neutrone (che rimane nel nucleo), un positrone ed un neutrino (che si allontanano dal nucleo).
![]()
![]()
Cattura elettronica (cattura K). Si produce quando uno degli elettroni presenti nel guscio più vicino al nucleo (livello K) viene catturato da un protone che si trasforma in un neutrone ed un neutrino
![]()
![]()
Agli inizi del '900 vi erano dunque sufficienti elementi per formulare un modello atomico coerente. Nel 1904 J.J. Thomson ipotizzò che gli atomi fossero costituiti da una massa carica positivamente, uniformemente distribuita, all'interno della quale erano presenti gli elettroni, carichi negativamente, in numero tale da determinare l'equilibrio delle cariche e quindi la neutralità.
Per cercare di chiarire la reale distribuzione delle cariche positive e negative che costituiscono l’atomo è possibile studiare gli effetti di deflessione (scattering o diffusione) che queste producono su particelle-proiettile dotate di carica. Tale tecnica, oggi divenuta molto comune per sondare la struttura della materia, fu utilizzata per la prima volta proprio sull’atomo, utilizzando come proiettili particelle a e b.
Nel 1911 Rutherford, a conclusione di una serie di esperimenti di scattering condotti sugli atomi, giunse a modificare profondamente il modello di Thomson
In tali esperimenti vennero fatte collidere particelle a con sottilissimi fogli metallici di oro o platino.
Il loro comportamento risultò sorprendente ed incompatibile con il modello di Thomson: la maggior parte delle particelle attraversava indisturbata il diaframma metallico proseguendo in linea retta, ma alcune particelle subivano vistose deflessioni, in alcuni casi rimbalzando addirittura indietro. Il numero delle particelle deviate risultava correlato al numero atomico degli atomi bombardati.
L’esperienza suggerisce che:
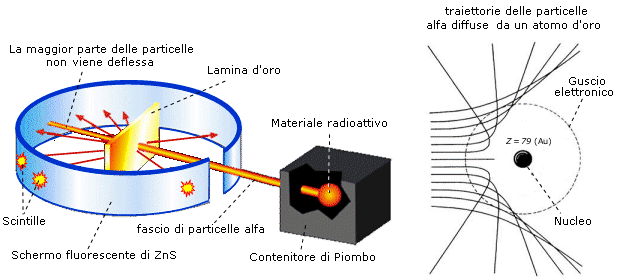
Infatti se la carica positiva fosse diffusa, distribuita uniformemente su tutto il volume atomico, le particelle a sarebbero sottoposte sempre ad una forza risultante nulla o quasi nulla, sia passando all’interno di un atomo, sia passando tra gli atomi (è quel che accade utilizzando come proiettili-sonda gli elettroni, i quali attraversano la materia subendo deviazioni molto piccole, a causa della distribuzione più omogenea e diffusa delle cariche negative dell’atomo).
Per giustificare i risultati dei suoi esperimenti, Rutherford propose dunque un nuovo modello atomico, detto modello planetario con gli elettroni che andavano a costituire una specie di corteccia esterna al massiccio nucleo positivo, in modo da garantire la neutralità a livello macroscopico. Per non cadere nel nucleo, attirati dalla carica positiva in esso presente, gli elettroni negativi dovevano naturalmente possedere un'energia cinetica agente in senso opposto.
Da calcoli effettuati sulle percentuali e sugli angoli di deviazione, Rutherford giunse a calcolare che, mentre l'atomo doveva possedere un diametro dell'ordine di 10-8 cm, il nucleo avrebbe dovuto presentare un diametro dell'ordine di 10-12 -10-13 cm.
Lo stesso Rutherford proporrà in seguito di chiamare protone il nucleo dell’elemento più leggero, l’idrogeno. L'esistenza dei protoni venne definitivamente confermata nel 1925 da Blackett, il quale riuscì ad ottenere immagini fotografiche (camera di Wilson) della trasmutazione dell'azoto,
che, colpito da una particella si trasforma in un nucleo di ossigeno e libera un protone del suo nucleo.
![]()
Solo molto più tardi (1932) James Chadwick, bombardando il Berillio con particelle a, scoprì che nei nuclei sono presenti anche particelle neutre, aventi una massa dello stesso ordine di grandezza del protone, anche se leggermente superiore, che vennero chiamati neutroni .
![]()
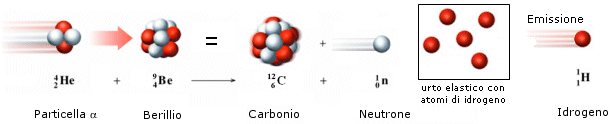
La scoperta dei neutroni permise di giustificare completamente l'esistenza degli isotopi, scoperti in precedenza da Thomson. Inoltre permise di classificare gli atomi dei vari elementi in funzione del numero dei protoni presenti nel loro nucleo.
Il modello di Rutherford presentava tuttavia gravi difetti in quanto gli elettroni che ruotano intorno al nucleo dovrebbero perdere energia cinetica sotto forma di emissione di radiazione elettromagnetica, come previsto dalle leggi dell’elettrodinamica, finendo per cadere sul nucleo. Inoltre gli atomi, in opportune condizioni, sono in grado di emettere e assorbire radiazione elettromagnetica secondo modalità che il modello planetario di Rutherford non era in grado di giustificare.
Fu pertanto necessario introdurre un nuovo modello atomico. Ma prima di parlarne è necessario affrontare, sia pur brevemente, il problema della natura della radiazione elettromagnetica e dei fenomeni di interazione che essa manifesta con la materia.
Bombardando il Berillio con particelle alfa esso emetteva una radiazione invisibile, che non veniva in alcun modo deflessa da campi magnetici o elettrici, il cui unico effetto era di provocare l'emissione da parte di un bersaglio di paraffina, contro cui era diretta, di protoni. Applicando semplicemente il principio di conservazione dell'energia e della quantità di moto e supponendo elastici gli urti tra le particelle, Chadwick fu in grado di calcolare la massa dei neutroni
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve