I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
APPUNTI DI CHIMICA
LE GRANDEZZE FONDAMENTALI DEL SI
La CHIMICA è una scienza sperimentale perché si pone una domanda e cerca di rispondere alla domanda con un esperimento.
Alla base della chimica c’è il metodo scientifico : OSSERVAZIONE-SPERIMENTAZIONE -LEGGI GENERALI
La MISURAZIONE svolge un ruolo essenziale per il controllo e la ripetibilità degli esperimenti
Che cosa significa misurare?
Vedere quante volte è contenuta una grandezza nel campione da misurare.
Due grandezze sono direttamente proporzionali quando all’aumentare di una aumenta anche l’altra. Il loro rapporto è costante e graficandole in un piano cartesiano si ottiene una retta:
Due grandezze sono inversamente proporzionali quando una aumenta e l’altra diminuisce. Il loro prodotto è costante e graficandole in un piano cartesiano si ottiene un’iperbole:
Le grandezze fondamentali del Sistema Internazionale (SI) sono 7:
Il PESO è la forza (si misura in newton) con cui una massa è attratta al centro della terra.
L a MASSA è la quantità che costituisce un corpo ( si misura in Kg)
L’unita di misura della pressione è il PASCAL
L’unita di misura dell’ENERGIA è il JOULE
L’unita di misura della TEMPERATRA è il KELVIN
Come si passa da gradi Centigradi a gradi KELVIN? Si somma 273 al grado centigrado
La FORZA si misura in NEWTON
LA PRESSIONE si misura in Pascal
![]()
L’accelerazione è = metri al secondo2
La massa si misura in kg
La temperatura si misura in K
Il tempo si misura in S
Quantità di sostanza si misura in mol
Corrente elettrica si misura in A
Intensità luminosa si misura in cd (Candela)
Area si misura in m2
Volume si misura in m3
Densità si misura in Kg /m3
Pressione si misura in Pa
Energia si misura in Joule
Frequenza si misura in Hertz
Cari elettrica si misura in C
CHE COSA E’ UNA GRANDEZZA FISICA?
Una grandezza fisica è quella che si può misurare:
si definiscono grandezze intensive della materia quelle grandezze che non dipendono dalla quantità del campione
Viceversa:
Si definiscono grandezze estensive della materia quelle grandezze che dipendono dalla quantità del campione
Consideriamo come campione dell'acqua distillata. Le grandezze che non dipendono dalle dimensioni del campione e quindi dalla quantità di acqua sono grandezze intensive. La temperatura di ebollizione, la temperatura di fusione e la densità dell'acqua sono grandezze indipendenti dalla quantità di acqua e quindi sono grandezze intensive.
Viceversa, la massa e il peso sono grandezze che dipendono dalla quantità di acqua a disposizione e quindi sono grandezze estensive.
Esempi di grandezze intensive sono: temperatura di ebollizione, temperatura di fusione, densità, peso specifico, calore specifico, molarità, normalità, pressione.
Esempi di grandezze estensive sono: massa, volume, lunghezza, area, entropia, entalpia, quantità di calore, energia.
CARATTERISTICHE MACROSCOPICHE DELLA MATERIA
La materia si presenta in diversi stati di aggregazione :
Solido – ha una forma propria e volume proprio
Liquido – non ha una forma propria ma un volume proprio
Aeriforme- non ha volume nè forma propria
Si può passare da uno stato ad un altro: passaggi di stato – processi fisici cioè che non cambiano la composizione della materia.
PASSAGGI DI STATO 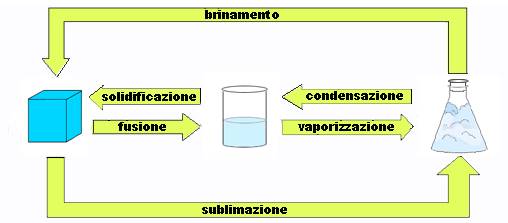
I passaggi di stato si ottengono agendo sulla temperatura e sulla pressione.
Se la sostanza è pura, con un solo elemento, la temperatura resta costante.
Che differenza c’è tra evaporazione ed ebollizione?
L’ acqua evapora a 30° ; si ha ebollizione a 100°
Quindi dipende dalla temperatura. La temperatura di ebollizione dipende dalla pressione : + è alta la pressione + è alta la temperatura. Si deve considerare :
la densità che ci dà l’idea della compattezza della nostra materia si misura in kg/m3
![]()

 AZIONI MECCHANICHE E TERMICHE SUI CORPI:
AZIONI MECCHANICHE E TERMICHE SUI CORPI:
riscaldamento pressione
possono produrre deformazioni e variazioni di volume: i solidi ed i liquidi si dicono incomprimibili, i gas comprimibili.
LEGGI DEI GAS
Legge di Boyle: a temperatura costante, pressione e volume di un gas sono inversamente proporzionali (aumentando la pressione il volume diminuisce)
Prima legge Guy-Lussac: a pressione costante le variazioni di volume di un gas sono direttamente proporzionali a quella della temperatura
Seconda legge di Guy-Lussac: a volume costante ,le variazioni di pressione di un gas sono direttamente proporzionali a quelle della temperatura.
Il gas perfetto è quello che segue tutte e tre le leggi, non esiste in natura ma funge da riferimento al quale i gas reali si avvicinano molto.
LA MATERIA è COSTITUITA DA PARTICELLE che si muovono in modo caotico (moti browniani) e la temperatura di un corpo dipende dalla minore o maggiore velocità con cui si muovono le sue particelle.
Nei solidi le particelle hanno dei legami molto forti ma non rigidi
Nei liquidi le particelle scivolano una sull’altra.
Nei gas non sono legate fra di loro, ma possono muoversi in ogni direzione.
L’aumento del moto di agitazione dipende dalla dilatazione e dai cambiamenti di stato.
SOSTANZE PURE E MISCELE
La sostanza pura ha un solo tipo di molecola (acqua, ferro, rame….)
La miscela è caratterizzata dall’unione di più sostanze
MISCELE:
1) omogenee o soluzioni
Questi sistemi sono molto diffusi: l’acqua minerale o del rubinetto, la miscela per gli scooter, la candeggina per il bucato, l’alcol denaturato.
Le SOLUZIONI sono quindi miscugli omogenei formati da due o più componenti.
Il componente presente in quantità maggiore è detto SOLVENTE, l’altro (o gli altri) si chiama SOLUTO.
Il SOLVENTE è un materiale liquido mentre, prima di sciogliersi, il SOLUTO può essere in uno qualunque dei tre stati di aggregazione.
Ad esempio la COCA COLA è una soluzione in cui sono presenti SOLUTI SOLIDI (zucchero, caffeina, caramello), LIQUIDI (acido ortofosforico) e GASSOSI (soprattutto anidride carbonica
2)eterogenee (unione di sostanze che non si mischiano, ma che mantengono le proprie proprietà) acqua e olio, ferro e sabbia
Ora analizziamo i metodi di separazione:
Per separare i componenti delle miscele ci sono vari metodi:
Filtrazione |
Diverso stato di aggregazione dei componenti attraverso una attraverso CARTA DA FILTRO
|
Distillazione |
Separare componenti di 2 liquidi (acqua e sale) |
Cromatografia |
Diversa adsorbibilità :separare diversi soluti Presenti in un miscuglio omogeneo
|
Estrazione |
Diversa solubilità |
Centrifugazione |
Diverso stato di aggregazione Diversa densità |
Cristallizzazione |
Diverso stato di aggregazione Consente di separare sotto forma cristallina un solido (soluto) da una sua soluzione resa satura per evaporazione del solvente |
Decantazione |
Diverso stato di aggregazione dei componenti |
Calamita |
Magnetismo |
Setacciatura |
Diverse dimensioni |
La concentrazione di una soluzione dipende dalla quantità di soluto presente e si può esprimere in tre modi diversi:
Per soluzione satura si intende quella soluzione in cui la sostanza è sciolta completamente
Per solubilità si intende la quantità massima di sostanza che si può sciogliere in 100 gr di solvente; dipende dalla temperatura e dalla sostanza da sciogliere
Fonte: http://ipcgualdo.weebly.com/uploads/1/3/9/5/13953253/le_grandezze_fondamentali_del_si.doc
Sito web da visitare: http://ipcgualdo.weebly.com
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve