I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Chimica organica II
Introduzione
I fattori cruciali che devono essere considerati per effettuare un’alchilazione sono:
1) Le condizioni per la generazione di un carbonio nucleofilo
2) L’effetto delle condizioni di reazione sulla struttura e reattività del nucleofilo
3) Regio e stereo selettività della reazione di alchilazione
4) Il ruolo dei solventi, dei controioni e degli altri componenti di reazione che possono influenzare il livello di reazioni collaterali.
La generazione di carboanioni per deprotonazione richiede una scelta di una appropriata base di Bronsted. L’equilibrio favorirà la formazione dei carboanioni solo quando l’acidità del carbone acido è maggiore di quella dell’acido coniugato della base usata per la deprotonazione. Siccome molti composti carbonilici sono poco acidi (Pka >15) misure accurate della loro acidità sono impossibili in acqua, di conseguenza vengono determinate in solventi organici, e riferite al Pka in modo apprassimativo (consultare tabella 1-1).
I valori di Pk in DMSO sono normalmente più grandi che in acqua perché l’acqua stabilizza gli anioni tramite legami idrogeno più di quanto possa fare il DMSO.
L’ordine dei sostituenti che stabilizzano i carboanioni è:
NO2 > COR > CN » CO2R > SO2R > Ph » SR > H > R
Per ottenere una completa conversione dei chetoni in enolati è necessario usare solventi aprotici, in modo che la deprotonazione del solvente non competa con la formazione dell’enolato.
Basi utilizzate:
NaNH2; base coniugata di MSO; anione trifenilmetile; LDA (litiodiisopropilammide); sali di Li, Na e K di esametildisilazono.
Solventi aprotici utilizzati:
Tetraidrofurano e dimetossi etano(DME)
Altra caratteristica fisica importante è il grado di aggregazione del carbonio, che può essere influenzato sia dal solvente che dal controione.
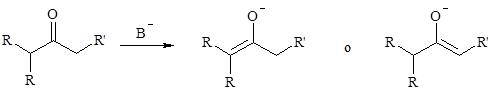
Un chetone dialchilico asimmetrico può formare due enolati regioisomeri per deprotonazione.
La composizione di una miscela di enolati può essere governata da fattori cinetici o termodinamici.
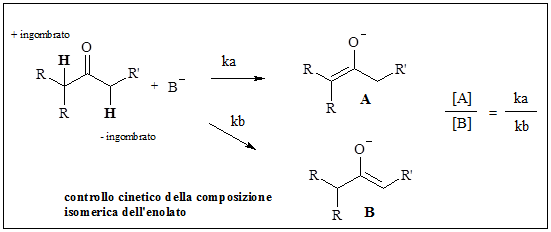
L’enolizzazione è governata da un controllo cinetico quando la deprotonazione è rapida, quantitativa e irreversibile.

E’ invece controllata in modo termodinamico quando i due enolati A e B formati dallo stesso chetone asimmetrico, possono essere interconvertiti; si stabilisce un equilibrio e la composizione dei prodotti riflette la stabilità termodinamica degli enolati (si viene meglio a formare l’enolato più sostituito).
Il controllo cinetico si può avere usando una base molto forte come LDA o esametildisilammide in un solvente aprotico e in difetto di chetoni.
Il litio è un controione migliore del sodio e del potassio per la generazione regioselettiva di un enolato cinetico. Infatti il litio mantiene un legame migliore con l’ossigeno e riduce così il grado di scambio di protoni.
Solventi aprotici sono indispensabili, perché solventi protici permettono un equilibrio degli enolati dovuto a un giuoco di reversibilità protonazione-deprotonazione che da origine ad una composizione di enolati controllati termodinamicamente.
Le condizioni di controllo cinetico di solito favoriscono l’enolato meno sostituito. Il motivo principale perché si ha questo risultato è perché la rimozione dell’idrogeno meno impedito e più veloce, per ragiono steriche. La rimozione del protone meno impedito conduce all’enolato meno sostituito.
I fattori sterici nella deprotonazione dei chetoni possono essere accentuate usando basi estremamente impedite. La base più largamente usata è lo ione di esametilammide, come sale di litio o di sodio. Altre basi più impedite possono essere usate per questo scopo.
In equilibrio l’enolato più sostituito di solito è la specie dominante. La stabilità del doppio legame C-C aumenta con l’aumento dei sostituenti, e quest’effetto porta alla maggiore stabilità dell’enolato più sostituito.
I termini controllo cinetico e controllo termodinamico sono applicabili alle altre reazioni di formazione di enolati. Possiamo affermare che un reagente o un insieme di condizioni favorisce la “produzione termodinamica“. Questa frase intende che il funzionamento del meccanismo è tale che dopo la formazione i vari possibili prodotti sono all’equilibrio.Quando questo è vero, il prodotto dominante può essere predetto considerando la stabilità relativa dei vari prodotti. Se una reazione è regolata a basso “ controllo cinetico “, la predizione o l’interpretazione delle quantità relative dei prodotti devono essere fatte analizzando le velocità che concorrono alla formazione dei prodotti.
E’ anche possibile realizzare enantioselettività nella formazione dell’enolato usando basi chirali.
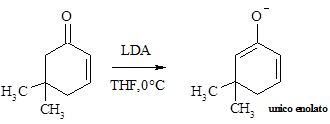
La deprotonazione sotto controllo cinetico di chetoni a,b-insaturi di solito accade preferibilmente al carbonio in alfa adiacente al gruppo carbonilico. L’effetto polare del gruppo carbonilico è probabilmente responsabile per la deprotonazione più veloce a questa posizione.
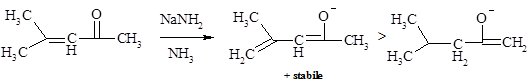
Sotto le condizioni del controllo termodinamico è l’enolato corrispondente alla deprotonazione al carbonio gamma che è presente in maggiore quantità.
Il I isomero di enolato si differenzia dal II perché è pienamente coniugato, infatti il sistema p nel II è croce-coniugato. Nell’isomero II, la delocalizzazione della carica negativa è ristretta all’ossigeno e al carbonio in alfa, mentre nel sistema coniugato del I, la carica negativa è delocalizzata sia sull’ossigeno e sul carbonio in alfa sia in quello gamma.
Il raggiungimento di condizioni sotto le quali i litio enolati sono stabili e non equilibrano con i regioisomeri, permette l’uso di altre reazioni in addizione all’eliminazione del protone. Ad esempio per generare enolati specifici.
Alcuni metodi sono mostrati nello Schema 1.4.
Il cloruro del trimetilsilil metano è adoperato appunto per formare il trimetilsilil etere dell’enolo. In questo modo si può in caso di una miscela separare i diversi regioisomeri per via cromatografica (per i sali, e gli enolati di litio lo sono, sarebbe molto dispendiosa una separazione).
Questi composti una volta formati possono essere lavati (cleavage) tramite metil litio (esempi 1 e 3 schema 1.4) o sali di tetraalchilammonio fluoruro (esempio 2).
La forza che guida quest’ultima tecnica di lavaggio è la formazione di un legame molto forte Si-F (142 kcal/mol).
Il trimetil silil enol etere può essere preparato direttamente dai chetoni. Una procedura include la reazione con il trimetil silil cloruro ed un’ammina terziaria. In questo modo si può ottenere enol etere termodinamicamente più stabile.
La stessa cosa vale per il t-butildimetil silil cloruro con il potassio idruro come base. Il trimetilsilil trifluorometano solfonato, il quale è più reattivo, da principalmente il prodotto meno sostituito.
Alte rese di trimetilsililenoletere meno sostituito possono essere inoltre raggiunte adoperando in una miscela di chetone e trimetilsilil cloruro le condizioni adatte per un controllo cinetico (- 78°C e LDA come base). Il metodo si può ulteriormente raffinare utilizzando basi più ingombranti come la t-octil-t-butilammina.
Ancora un altro metodo per preparare trimetil silil enoleteri specifici può risultare la riduzione 1,4 di chetoni a-b insaturi usando silani come riducenti ed un complesso Pt – diviniltetrametildisilossano come catalizzante (esempio 7), oppure Li e NH3 (esempio 6). Altri metodi verranno discussi più avanti.
1.4. Alchilazione degli enolati
L’alchilazione degli enolati è un processo sintetico molto importante. L’alchilazione di composti relativamente acidi come b-dichetoni, b-chetoesteri e esteri di acidi malonici può essere effettuata usando alcol come solventi e metalli alcossidi come basi.
La presenza di due gruppi sostituenti elettronattrattori facilita la formazione di un enolato risultante dalla rimozione di un protone dall’atomo di carbonio situato tra loro. L’alchilazione quindi va avanti con un processo SN2.
Alcune reazioni sono mostrate nello Schema 1.5.
L’agente alchilante deve essere molto reattivo nei confronti del posizionamento della carica nucleofila.
Alogenuri primari o solfonati, specialmente l’allilico ed il benzilico, sono gli agenti alchilanti migliori.
Sistemi secondari reagiscono molto lentamente e spesso danno rese basse per reazioni competitive di eliminazione. Alogenuri terziari danno solo prodotti di eliminazione.
Il gruppo metilenico acido può essere dialchilato se l’agente alchilante e la base sono in quantità sufficienti.
La dialchilazione può essere però un aspetto indesiderato della reazione se si vuole ottenere un prodotto monoalchilato.
L’uso di dialogenoalcani come agenti alchilanti porta alla formazione di anelli (esempio 7), si ha quindi la sintesi di composti ciclici per alchilazione intramolecolare.
I carboni relativamente acidi come quelli degli esteri malonici e dei b-chetoesteri furono la prima classe di composti utilizzata per produrre carbanioni per il semplice fatto che essi deprotonano facilmente tramite l’uso di ioni alcossido (i quali sono agevolmente preparabili).
La preparazione dei 2-sostituiti b-chetoesteri (esempi 1,4 e 8 sch.1.5) e dei 2-sostituiti derivati dell’estere malonico (esempi 2 e 7) è utile anche per la sintesi di chetoni e di acidi carbossilici (vedi sintesi acetoacetica dei chetoni). Infatti, sia i b-chetoacidi sia gli acidi malonici vanno incontro a facile decarbossilazione.
I carbanioni malonato ed acetoacetato sono gli equivalenti sintetici di carbanioni sintetici privi dei sostituenti degli esteri.Nella preparazione del 2-eptanone (es. 1, sch. 1.5 e 1.6), l’etilacetoacetato funge da equivalente sintetico dell’acetone. E’ anche possibile usare il derivato dilitio dell’acido acetoacetico come equivalente sintetico dell’enolato acetone.
In questo caso la decarbossilazione può verificarsi direttamente sul prodotto di alchilazione.
L’uso dei b-chetoesteri e degli esteri malonici è stato largamente soppiantato dallo sviluppo di più nuove procedure basate sulla formazione selettiva di enolati. Queste procedure permettono la diretta alchilazione del chetone e degli enolati degli esteri evitando l’idrolisi e la decarbossilazione dei chetoesteri intermedi.
La maggior parte delle alchilazioni sono estrapolate dalla deprotonazione del chetone sotto controllo cinetico o termodinamico. Altri metodi di preparazione degli enolati sono stati già affrontati nella Sezione 1.3 e alcuni esempi dell’alchilazione degli enolati del chetone sono dati nello Schema 1.7.
Un aspetto della reazione che è cruciale in molti casi è la stereoselettività. Lo step dell’alchilazione ha una preferenza stereoelettronica per l’approccio dell’elettrofilo perpendicolarmente al piano dell’enolato, in modo che gli elettroni coinvolti nella formazione del legame sono elettroni p.
L’elettrofilo attaccherà la meno ingombrata delle due facce, ed il livello di stereoselettività dipenderà solo dal differente ingombro sterico.
Ad esempio, il 4-t-butilcicloesanone potrà essere attaccato da un alchilante da entrambe le facce del piano dell’enolato, poiché l’opposizione sterica incontrata durante l’approccio dell’elettrofilo è minima.
Di conseguenza il rapporto fra i due steroisomeri alchilati sarà cis/trans = 1/1.
Il prodotto cis si può formare con uno stato di transizione che ha una conformazione twist atta a raggiungere i requisiti per un controllo stereoelettronico. Il fatto che questo percorso non è sfavorito è coerente con l’altra prova che lo stato di transizione nell’alchilazione dell’enolato si raggiunge presto e riflette principalmente le caratteristiche di struttura del reagente, non del prodotto. Uno stato di transizione tardivo potrebbe sfavorire la formazione dell’isomero cis per l’energia di tensione associata alla conformazione non chair del prodotto.
L’introduzione di sostituenti alchilici al carbonio in a nell’enolato intensifica la steroselettività in qualche modo. Per minimizzare l’interazione sterica con l’ossigeno solvatato, il gruppo alchilico è distorto dalla coplanarità. Ciò previene l’enolato dall’attacco dell’elettrofilo dalla direzione assiale. L’approccio alternativo dalla faccia superiore aumenterebbe l’interazione sterica forzando il gruppo alchilico a eclissarsi con l’ossigeno dell’enolato.
Quando un metile addizionale è piazzato al C-3, c’è una forte preferenza per l’alchilazione anti al gruppo 3-metile. Questo può essere attribuito alla conformazione dell’enolato, che piazza il metile in una conformazione pseudoassiale a causa di una tensione allilica (vedi parte A sez. 3.3).
Il gruppo 3-metile quindi protegge la parte più bassa dell’enolato.
Se l’alchilazione è intramolecolare, le restrizioni addizionali di conformazione riguardo l’approccio dell’elettrofilo sull’enolato diventano importanti.
I principi generali che regolano gli stadi di energia della chiusura intramolecolare per formare una struttura ciclica sono stati riassunti da Baldwin (vedi Parte A, Sez. 3.9).
Lo stato di transizione deve avere una geometria tale da permettere l’interazione degli orbitali p dell’enolato, in modo da raggiungere approssimativamente un allineamento con il gruppo uscente.
L’alchilazione probabilmente procede attraverso uno stato di transizione J. Lo stato di transizione K per la formazione dell’anello a giunzione trans sarebbe maggiormente teso per la necessità di attraversare la faccia opposta del sistema p dell’enolato.
Ricapitolando i maggiori fattori che contribuiscono alla stereoselettività dell’alchilazione dell’enolato sono:
In presenza di basi sufficientemente forti, come un alchil litio, sodio alchile, potassio idruro, sodio o potassio amide, o LDA, i composti 1-3 dicarbonilici possono essere convertiti nei loro dianioni attraverso due deprotonazioni sequenziali.
E’ importante e da tener presente che:
le reazioni di alchilazione dei dianioni avvengono sul carbonio più basico e non sul metilene attivato che si trova fra i due carbonili (come avveniva nell’alchilazione del mono-enolato).
Quindi secondo la forza e la quantità della base si possono ottenere composti 1-3 dicarbonilici alchilati sul metilene attivato o sul carbonio meno acido.
Una serie di esempi sono mostrati nello Schema 1.8.
Il tasso di alchilazione degli ioni enolati è fortemente dipendente dal solvente nel quale la reazione è portata avanti.
DMSO e N,N-dimetilformammide (DMF) sono particolarmente effettivi nell’incoraggiare la reattività degli ioni enolato.
Questi due composti appartengono alla classe dei solventi polari aprotici. Altri membri di questa classe sono l’N-metilpirrolidone (NMP) e la esametil triammide fosforica (HMPA).
I solventi polari aprotici sono composti che hanno un’alta costante dielettrica ma che mancano di gruppi idrossilici o altri gruppi con legami a idrogeno. Possiedono inoltre un’alta abilità nel coordinare i cationi metallici, in modo che loro possano solvatare e dissociare gli enolati ed altri carbanioni da coppie ioniche e gruppi.
Il più alto livello di reattività, il quale può essere avvicinato ma non raggiunto in soluzione, è quello del “nudo” anione enolato desolvatato.
Per una coppia ionica enolato-ione metallico in soluzione, la massima reattività la si potrebbe aspettare in un intermedio nel quale il catione sia prevalentemente solvatato rispetto all’anione enolato che invece deve essere il meno solvatato possibile.
I solventi polari aprotici sono buoni solvatatori di cationi e scarsi solvatatori di anioni.
Ciò è assimilabile al fatto che ciascuno di essi ha un O polarizzato negativamente, avviabile per la coordinazione al catione metallo-alcalino.
Perciò questi solventi danno un intermedio nel quale la coppia ionica metallo-enolato viene dissociata per dare un anione enolato meno ingombrato e più reattivo.
I solventi polari protici possiedono anch’essi un’abilità pronunciata di separare le coppie ioniche ma sono meno favoriti come solventi per l’alchilazione degli enolati perché loro coordinano insieme sia lo ione metallico, sia lo ione enolato.
Avviene così la solvatazione dell’anione enolato mediante legami a idrogeno. L’anione enolato solvatato può reagire così in tutt’altro modo e determinare una O-alchilazione al posto di una C-alchilazione.
Il THF e il DME sono solventi leggermente polari e sono dei moderati solvatatori di cationi.
La coordinazione al catione metallico coinvolge la coppia solitaria dell’atomo di O.
Questi solventi, per la loro bassa costante dielettrica, sono meno effettivi nel separare le coppie ioniche o gli aggregati rispetto ai solventi polari aprotici.
Le strutture cristalline del litio e potassio enolato del metil t-butil chetone sono state determinate grazie alla cristallografia a raggi X e sono rappresentate nelle figure (per questo motivo si parla di “aggregati”).
La figura rappresenta lo stato solido, invece aggregati esamerici costituiscono una buona indicazione della natura degli enolati in solventi debolmente coordinanti.
Nonostante tutto, il THF ed il DME sono i solventi più comunemente utilizzati per alchilazioni di enolati.
Essi inoltre sono i solventi maggiormente consigliati per una generazione di enolati che devono essere alchilati sotto controllo cinetico e presentano dei vantaggi nelle fasi della purificazione e del “workup” sui prodotti rispetto ai solventi polari aprotici. La reattività degli enolati in questi solventi può essere rafforzata aggiungendo un reagente che può legare i cationi metallo-alcalini con più forza.
Esempi di questi reagenti sono il tetrametiletilendiammina (TMEDA) e gli eteri ciclici.
La reattività degli enolati è anche influenzata dal tipo di controione adoperato nella base.
Tra gli ioni più comunemente usati l’ordine di reattività è:
Mg2+ < Li+ < Na+ < K+
Il motivo di quest’ordine di reattività è riconducibile alle caratteristiche dei solventi. I cationi più piccoli e con una carica più densa, Mg2+ e Li+, sono maggiormente associati all’enolato rispetto agli ioni Na+ e K+.
Gli anioni enolati sono nucleofili ambidentati. L’alchilazione di un enolato può avvenire sia al carbonio che all’ossigeno. Considerando che la carica negativa dovrebbe risiedere sull’O, la O-alchilazione dovrebbe essere dominante. E’ possibile però stabilire delle condizioni di reazione tali da favorire l’alchilazione sul carbonio.
La O-alchilazione è più pronunciata quando l’enolato è dissociato. Quindi essa è comandata sia dalla natura del solvente, che da quella del controione.
Nel momento in cui il sale potassico del etil acetoacetato è trattato con dietil solfato nel solvente polare aprotico HMPA, il prodotto maggiore (83%) è l’O-alchilato.
Nel THF, dove avviene l’aggruppamento degli ioni, tutto il prodotto è C-alchilato. Nel t-butanolo, dove l’anione acetoacetato è legato con un ponte a idrogeno dal solvente, si osserva ancora la C-alchilazione.
Rapporti più alti della C/O alchilazione sono osservati con gli alogenuri alchilici, piuttosto che con i solfonati ed i solfati. Il più alto fra questi è quello osservato per lo ioduro alchilico. Per l’etilazione del sale potassico dell’etile acetoacetato nell’HMPA, vengono ottenute le composizioni del prodotto mostrate sotto.
Gli effetti del gruppo uscente sul rapporto C/O alchilazione può essere correlato dalla corrispondenza
“hard-soft-acid-base”. Dei due siti nucleofili di uno ione enolato, l’O è più “hard” del C.
Le reazioni di sostituzione nucleofila di tipo SN2 procedono meglio quando sia il nucleofilo che il gruppo uscente sono entrambi o hard o soft.
Di conseguenza, lo ioduro d’etile, con il gruppo uscente molto soft quale lo iodio, da l’alchilazione al carbonio piuttosto che all’ossigeno.
D’altra parte, gruppi uscenti con l’O, come i solfonati o i solfati , sono gruppi hard e quindi l’alchilazione si ha una O-alchilazione.
La combinazione hard-hard è anche favorita da uno stato di transizione precoce, dove la distribuzione di cariche è un fattore molto importante.
La combinazione soft-soft invece è favorita da un tardo stato di transizione, dove la parziale formazione del legame è il fattore dominante.
In definitiva il prodotto della C-alchilazione è più stabile di quello della O-alchilazione poiché l’energia di legame di C=O + C-C è maggiore dell’energia di legame C=C + C-O.
Perciò le condizioni che favoriscono un dissociato, e più reattivo enolato, favoriscono la O-alchilazione.
Per riassumere: la resa per la O-alchilazione è massima dall’uso di solfati alchilici o solfati arilici in un solvente polare aprotico;
la resa per la C-alchilazione è massima se si usa un alogenuro alchilico in un solvente meno polare o protico.
L’alchilazione intramolecolare degli enolati conduce alla formazione di prodotti ciclici.
In addizione agli altri fattori che governano l’equilibrio C/O nelle rese dell’alchilazione, l’elemento del controllo stereoelettronico gioca un ruolo importante in casi del genere.
Per far si che la C-alchilazione possa avvenire, l’orbitale p del carbonio in a deve essere allineato con il legame C-Br nella geometria lineare associata con lo stato di transizione SN2. Quando l’anello da chiudere è a sei membri, questa geometria è accessibile, e la ciclizzazione a cicloesanone si realizza. Con anelli a cinque membri, l’allineamento non può essere raggiunto facilmente.
La ciclizzazione all’O avviene quindi più facilmente della formazione del ciclopentanone. Lo stato di transizione per la O-alchilazione coinvolge un orbitale dell’O con una coppia solitaria di elettroni (lone-pair orbital) e porta ad una minore tensione rispetto allo stato di transizione della C-alchilazione.
Negli enolati formati dall’eliminazione di un protone nei chetoni a-b insaturi, ci sono tre siti potenzialmente adatti per un’alchilazione o per una protonazione: l’O, l’a-C ed il g-C. Il sito preferito cineticamente è l’a-C.
La protonazione degli enolati è un utile metodo per trasformare composti a-b insaturi (chetoni, esteri) nei corrispettivi e meno stabili b-g insaturi.
Un caso interessante da analizzare è quello degli ioni fenossido; essi danno solitamente la O-alchilazione poiché la C-alchilazione dovrebbe rompere la coniugazione aromatica dell’anello benzenico.
Tuttavia in solventi che possono stabilire con l’O dei legami idrogeno molto forti, si possono misurare alte rese di C-alchilazione.
Fonte: http://digilander.libero.it/ctfonline/appunti/file/organica2.doc
Sito web da visitare: http://digilander.libero.it/ctfonline
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve