I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
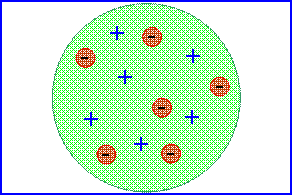
1. Modello atomico di Thomson
In seguito alla conferma sperimentale della presenza di cariche elettriche negli atomi (scoperta dell’elettrone nel 1896) e al fatto che l’atomo fosse neutro (quindi ![]() ) J.J. Thomson elaborò un modello secondo il quale l’atomo era composto da una sfera di raggio
) J.J. Thomson elaborò un modello secondo il quale l’atomo era composto da una sfera di raggio ![]() comprendente particelle positive uniformemente distribuite su tutta la sfera e grumi di carica negativa (elettroni) inseriti come uvetta in un panettone.
comprendente particelle positive uniformemente distribuite su tutta la sfera e grumi di carica negativa (elettroni) inseriti come uvetta in un panettone.
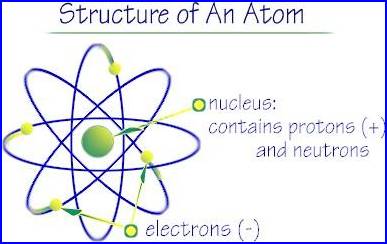
2. Modello atomico di Rutherford
Secondo il modello atomico di Rutherford la carica elettrica positiva non risultava più uniformemente distribuita all’interno dell’atomo, bensì concentrata in un nucleo il cui diametro risulta ![]() volte più piccolo dell’atomo stesso.
volte più piccolo dell’atomo stesso.
I punti essenziali del modello risultano essere:
Siccome la legge di Coulomb che prevede una attrazione tra nucleo ed elettroni ha una forma del tutto analoga alla legge di gravitazione universale allora gli elettroni devono essere in movimento (traiettorie ellittica approssimabile in una circonferenza) per non schiantarsi sul nucleo stesso e seguono le leggi di Keplero che regolano il movimento dei pianeti.
Su queste basi calcoliamo possiamo calcolare l’energia posseduta dall’elettrone; tale energia sarà di natura cinetica e potenziale elettrostatica.
Energia cinetica: ![]()
Energia potenziale elettrostatica: ![]()
Energia totale elettrone: ![]()
Dal valore dell’energia dell’elettrone (detta anche energia di legame) si deduce che l’elettrone è tanto più fortemente legato al nucleo quanto minore è il raggio della sua orbita. Tale modello sembra anche in grado di spiegare l’origine delle righe spettrali, infatti una carica rotante equivale ad una carica oscillante ed è in grado di generare onde elettromagnetiche. Però se un elettrone ruotando irradia energia le sue orbite dovrebbero diventare sempre più piccole ed alla fine esso dovrebbe cadere sul nucleo. Come conseguenza o il modello era sbagliato o le leggi dell’elettrodinamica classica non potevano essere applicate all’atomo.
3. Modello atomico di Bohr
Per risolvere tali problemi di interpretazione il fisico danese Niels Bohr, ispirandosi all’ipotesi dei quanti, introdusse i seguenti postulati:
Sulla base di questi postulati si possono formulare le seguenti osservazioni:
se un elettrone si trova già sull’orbita più bassa disponibile non potrà avvenire alcuna transizione e quindi non si avrà irraggiamento.
Perché si verifichi l’emissione di radiazione è pertanto necessario che uno o più elettroni abbiano in precedenza ricevuto energia dall’esterno e si siano portati su di un’orbita di energia più alta.
L’atomo messo in condizione di irraggiare è detto eccitato, mentre l’atomo non eccitato è detto trovarsi nello stato fondamentale.
Applicazione del modello all’atomo di idrogeno
Applicando la quantizzazione della quantità di moto (2° postulato di Bohr) ![]() alla formula dell’energia cinetica dell’elettrone
alla formula dell’energia cinetica dell’elettrone ![]() si può ottenere il raggio dell’orbita associata al numero intero n attraverso il procedimento seguente:
si può ottenere il raggio dell’orbita associata al numero intero n attraverso il procedimento seguente:
Ottenuto i valore di energia della varie orbite si può riformulare il terzo postulato ottenendo la seguente formula che ci permette di ricavare la frequenza della radiazione emessa nel passaggio dell’elettrone dal livello energetico iniziale ![]() a quello finale
a quello finale ![]() :
:
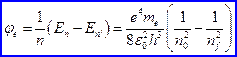
Tale formula coincide con la formula di Ritz sia formalmente che quantitativamente una volta verificato che sia rispettata l’uguaglianza ![]() .
.
Grazie all’introduzione dei postulati di Bohr si era così giunti alla giustificazione scientifica delle frequenze di emissione dell’atomo di idrogeno che fino ad allora erano descritte da sole leggi empiriche.
La risoluzione che abbiamo appena visto applicata all’atomo di idrogeno non è sempre possibile per atomi aventi più elettroni in quanto si moltiplica il numero di forze tra le particelle (nucleo ed elettroni); ma esistono altri casi in cui è possibile affrontare tale risoluzione:
4. Perfezionamento di Sommerfeld del modello
Abbiamo intravisto alcune difficoltà che rimanevo però irrisolte dal modello atomico di Bohr; la teoria ad esempio non dava alcuna informazione riguardante l’intensità delle righe emesse negli spettri e non riusciva (metalli alcalini) a prevedere tutte le frequenze spettroscopiche.
Un altro limite che abbiamo visto era la difficoltà ad estendere il modello ai sistemi atomici formati da più di elettrone.
Per migliorare la teoria in modo da avvicinarla il più possibile ai risultati sperimentali sono state introdotte nuove regole di quantizzazioneche hanno portato alla definizione di 4 numeri quantici:
1 à Il numero quantico principale [n]
Rappresenta il numero intero che caratterizza la quantizzazione sulle orbite introdotta da Bohr ed è indicato con n.
2 à Il numero quantico secondario o azimutale [l]
Si era visto che in certi atomi (ad esempio metalli alcalini) gli elettroni potevano ruotare su traiettorie circolari o ellittiche e tale differenza di eccentricità portava a differenti stati energetici associabili all’elettrone.
In particolare nei metalli alcalini l’elettrone ottico è tanto più legato al nucleo quanto maggiore è l’eccentricità (a parità di asse maggiore), mentre ciò non vale nell’idrogeno che non ha una nuvola di elettroni non di legame nel nocciolo.
Anche questi stati energetici in accordo con spettri di emissione non continui bensì a righe doveva risultare quantizzata. Quindi l’eccentricità non potrà risultare continua. A tal fine Sommerfeld introdusse un numero quantico secondario (azimutale) indicato con l che, per ogni strato principale individuato dal numero quantico principale, individua più sottostrati ciascuno individuato da una specifica eccentricità.
Inoltre Sommerfeld introdusse regole di selezione in grado di dire quali passaggi tra orbite fossero permesse e nel caso del numero quantico azimutale tale regola indica ![]() .
.
Il numero quantico magnetico [m]
Sappiamo che quando un atomo si trova in un campo magnetico sull’elettrone agisce la forza di Lorentz che tende ad orientare il piano dell’orbita descritta dalla carica in moto. Anche in questo caso la quantizzazione dell’energia ci impone che il piano orbitale possa assumere solo determinati orientamenti spaziali individuati da un terzo numero quantico denominato numero quantico magnetico (m).
Il numero quantico di spin [s]
Poiché i numeri quantici n,l,m non erano ancora in grado di giustificare tutte le righe spettrali emesse dagli atomi eccitati nel 1925 fu aggiunto un quarto numero quantico che prevede che l’elettrone possa avere anche un moto di rotazione intrinseco attorno al proprio asse . Tale movimento poteva avere solo due rotazioni ammissibile (verso orario e antiorario) ed era identificato dal numero quantico di spin (s).
I quattro numeri quantici e le diverse regole che descrivono i passaggi tra i vari stati sono riassunti nella seguente tabella
NOME |
SIMB. |
DESCRIZIONE |
REGOLA DI QUANTIZZ. |
STATI AMMISS. |
REGOLA DI SELEZIONE |
N° quantico principale |
n |
Indica il raggio dell’orbita |
|
n=1,2,….. |
|
N° quantico azimutale |
l |
Indica l’eccentricità dell’orbita |
|
l=0,…n-1 |
|
N° quantico magnetico |
m |
Indica la disposizione dell’orbita in relazione alle linee di forza del campo magnetico |
|
|
|
N° quantico di spin |
S |
Indica il momento angolare intrinseco |
|
|
|
5. Tavola periodica degli elementi
Il criterio base che sancisce la distribuzione degli elettroni negli atomi è rappresentato dal principio di esclusione di Pauli che recita:
dato un sistema comunque numeroso di elettroni in un atomo non possono trovarsi due elettroni aventi la stessa quaterna di numeri quantici.
Inoltre in condizioni normali ogni elettrone tende ad occupare gli starti più interni cioè quelli associati a livelli energetici più bassi.
Questi principi permettono di interpretare in modo naturale la struttura del sistema periodico degli elementi; poiché sulle condizione imposte ai numeri quantici ogni strato contrassegnato da un numero quantico principale può contenere al massimo ![]() elettroni discende che lo strato:
elettroni discende che lo strato:
In conclusione si può affermare che
Il chimico russo Mendeleev aveva già proposto un primo sistema periodico degli elementi. Nella sua forma più moderna (dovuta a Mosley) la tavola periodica è ordinata in base al crescere dei numeri atomici Z (e non più in base alla massa atomica). Si ricordi che Z rappresenta il numero di protoni (uguale al numero di elettroni) presenti nell’atomo.
La distribuzione periodica delle proprietà e delle caratteristiche chimico – fisiche consentì di prevedere la scoperta di elementi ancora sconosciuti.
Fonte: http://www.visus01.altervista.org/files/ottica%20fisica/12%20Fisica%20Atomica.doc
Sito web da visitare: http://www.visus01.altervista.org
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve