I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Sono metodi di analisi strumentale che, a differenza dei metodi potenziometrici, operano in condizioni lontane dall'equilibrio elettrochimico. E’ interessante il confronto tra potenziometrica ed elettrolisi. Nella potenziometria si costruisce una pila con una coppia di elettrodi (uno di misura e l'altro di riferimento, eventualmente uno solo di tipo combinato) che costituiscono una cella elettrochimica e misurando il potenziale (in realtà la d.d.p.) della pila all'equilibrio cioè con passaggio di corrente nullo tra gli elettrodi.
Nei metodi elettrolitici si applica un potenziale esterno diverso da quello di equilibrio, cioè da quello che avrebbero spontaneamente in soluzione. A tale scopo viene collegato agli elettrodi, immersi in una soluzione di elettroliti, un generatore esterno di corrente continua (una pila) in modo che l'energia trasferita agli elettrodi produca una serie di fenomeni elettrochimici, non spontanei, detti nel loro complesso elettrolisi. Un dispositivo di tale genere è detto cella elettrolitica e comprende due elettrodi: un anodo (+) ed un catodo (-), collegati ai relativi poli del generatore esterno. Quando viene chiuso il circuito, la corrente che passa provocherà delle reazioni di scarica degli ioni dell'elettrolita agli elettrodi (ossidazioni o riduzioni), che dipendono dalla natura degli elettrodi e dell'elettrolita.
Verranno ora discussi i concetti di base dei metodi elettrolitici, con particolare riferimento all'elettrogravimetria, che costituisce l'applicazione analitica principale.
E’ il fenomeno opposto alla pila: si tratta di un processo in cui, mediante una corrente elettrica continua esterna, viene fatta avvenire una reazione elettrochimica di scarica non spontanea; in questo fenomeno si ha perciò conversione di energia elettrica in energia chimica. Si utilizza un dispositivo detto cella elettrolitica, in cui sono presenti due elettrodi, un anodo ed un catodo, che hanno segni opposti a quelli della pila e che richiamano per effetto del loro campo elettrico, gli ioni della soluzione di elettrolita sottoposta ad elettrolisi:
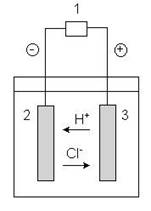 1: sorgente di corrente continua (pila o accumulatore) 2: catodo (per esempio di grafite)
1: sorgente di corrente continua (pila o accumulatore) 2: catodo (per esempio di grafite)
3: anodo (per esempio di grafite)
Anche se i segni sono opposti a quelli della pila occorre sottolineare che i processi elettrochimici sono gli stessi: al catodo avvengono sempre riduzioni mentre all’anodo avvengono sempre ossidazioni. Ad esempio sottoponendo ad elettrolisi una soluzione di HCl, l’elettrolita forte si dissocia in H+ e Cl- e quindi gli ioni migrano all’elettrodo di segno opposto dive possono scaricarsi:
al catodo (riduzione) 2H+ + 2e- H2(g) all’anodo (ossidazione) 2Cl- Cl2(g) + 2e-
con sviluppo di H2 gassoso al catodo e di Cl2 gassoso all’anodo.
Da notare che se i due elettrodi fossero stati collegati sotto forma di pila le due semireazioni sarebbero avvenute spontaneamente in senso opposto. Il Cl2 si sarebbe ridotto a Cl- (avendo un maggiore potere ossidante con un E° = 1,36 V) ed avrebbe costituito il catodo (+) mentre l’H2 si sarebbe ossidato ad H+ (avendo un E° = 0,00 V), costituendo l’anodo (-), a conferma che pila ed elettrolisi sono due fenomeni opposti.
Il fenomeno dell’elettrolisi è regolato dalle due leggi di Faraday, dedotte nel 1833:
Utilizzando le due leggi di Faraday si possono effettuare calcoli quantitativi sui processi di scarica agli elettrodi.
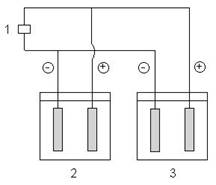 Per illustrare le leggi di Faraday si consideri un sistema formato da 2 celle elettrolitiche in parallelo (2 e 3) collegate ad un generatore di corrente continua (1). Si supponga cha nelle due celle avvengano due diverse riduzioni catodiche:
Per illustrare le leggi di Faraday si consideri un sistema formato da 2 celle elettrolitiche in parallelo (2 e 3) collegate ad un generatore di corrente continua (1). Si supponga cha nelle due celle avvengano due diverse riduzioni catodiche:
cella 2: Cu2+ + 2e- Cu cella 3: Al3+ + 3e- Al
Facendo passare la stessa quantità di carica: Q = i·t nelle due celle si ridurranno un identico numero di equivalenti elettrochimici ma massa diverse di Cu e di Al
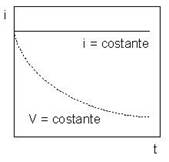
Riportando su di un diagramma come varia l’intensità di corrente nella cella elettrolitica in funzione della d.d.p. applicata agli elettrodi (V), si ottiene la seguente curva tensione-corrente:
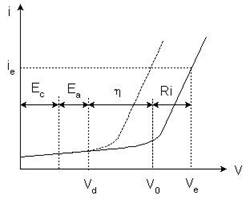 Ec: potenziale assunto dal catodo Ea: potenziale assunto dall’anodo η : sovratensione totale
Ec: potenziale assunto dal catodo Ea: potenziale assunto dall’anodo η : sovratensione totale
R·i : caduta ohmica della cella Vd: tensione di decomposizione V0: tensione teorica di scarica Ve: tensione effettiva di scarica
Inizialmente la corrente è praticamente nulla perché non avvengono reazioni di scarica agli elettrodi se non la scarica di eventuali impurezze presenti in tracce. Aumentando la tensione applicata agli elettrodi l’elettrolisi dovrebbe iniziare alla tensione pari a Vd detta tensione di decomposizione, determinata dai potenziali assunti dagli elettrodi, catodo (Ec) ed anodo (Ea), calcolabili con l’equazione di Nerst, in base alle specie chimiche presenti ed alla loro concentrazione, cioè:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ovvero, tenendo conto del segno (-) assunto dal catodo:
ovvero, tenendo conto del segno (-) assunto dal catodo:
Nel diagramma si nota che Vd è la somma grafica dei due segmenti che corrispondono a Ea e a Ec. Sperimentalmente, tuttavia, non si vedrebbe un apprezzabile passaggio di corrente ed infatti la curva rimane piatta. Infatti la scarica degli ioni agli elettrodi richiede un’energia supplementare più o meno grande, detta sovratensione η (eta), che dipende sia dalla natura dell’elettrodo su cui avviene la scarica, che può facilitarla o renderla più difficile, sia da particolari fenomeni legati alla scarica dell’elemento che si scarica:
![]()
![]()
![]()
![]()
![]()
![]()
![]() relative cioè sia all’anodo che al catodo, si ottiene quindi:
relative cioè sia all’anodo che al catodo, si ottiene quindi: ![]()
![]() dove V0 è la tensione teorica di scarica
dove V0 è la tensione teorica di scarica
Quando si raggiunge V0 l’elettrolisi inizia e quindi la curva cresce rapidamente, evidenziando un netto aumento della corrente che passa nel circuito, a causa della scarica degli ioni agli elettrodi.
La sovratensione di scarica dipende da numerosi fattori, cioè vi sono vari tipi di sovratensione:
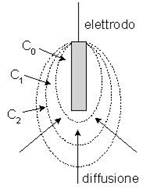
Vicino all'elettrodo si ha la scarica della specie elettroattiva, che non viene immediatamente rimpiazzate dalla migrazione degli ioni adiacenti e ciò provoca la formazione di un gradiente di concentrazione attorno all’elettrodo: strati di liquido nei quali diminuisce progressivamente la concentrazione della specie che si scarica, fino ad annullarsi nello strato adiacente all’elettrodo, cioè: C2 > C1 > C0. Il gradiente di concentrazione innesca la diffusione degli ioni dal corpo della soluzione, più lontana dall’elettrodo, dove la concentrazione della specie elettroattiva è pressoché costante. Poiché la velocità di diffusione è di solito bassa, il processo diffusivo non riesce a "rimpiazzare" completamente gli ioni scaricati. Occorre quindi una tensione “in più” per aumentare la velocità di diffusione che coincide con la sovratensione di diffusione. Si può limitare la polarizzazione dell’elettrodo agitando energicamente la soluzione e scaldando
Se venisse applicata la tensione teorica di elettrolisi V0 come d.d.p. agli elettrodi, la corrente circolante sarebbe molto piccola e ciò comporterebbe tempi di idrolisi molto lunghi. In pratica si utilizza la tensione effettiva Ve:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
essendo R·i la caduta ohmica della cella. In effetti, applicando questa tensione agli elettrodi, si completa l’elettrolisi in tempi ragionevoli in quanto in corrispondenza di Ve la cella elettrolitica è attraversata dalla corrente ie elevata, che aumenta la mobilità ionica e facilita la scarica agli elettrodi.
Il valore di tensione da applicare agli elettrodi deve essere calcolato per impedire fenomeni parassiti che
abbasserebbero il rendimento del processo come:
I processi elettrolitici hanno una notevole importanza:
L'elettrogravimetria (o elettrodeposizione) è il più vecchio dei metodi elettrolitici; risale infatti al 1864 ma ancora oggi trova alcune applicazioni, anche se non molto vaste, soprattutto in alcuni tipi di analisi (metalli e leghe).
Il principio è quello di realizzare delle riduzioni catodiche (molto raramente delle ossidazioni anodiche), provocando cioè la scarica quantitativa di un elemento metallico su di un catodo metallico inerte a peso noto: dall'incremento di peso del catodo, al termine del processo, si risale alla quantità di elemento scaricato e quindi
alla concentrazione della soluzione analitica di partenza. Si tratta quindi di un metodo di analisi gravimetrico in cui l'elettrone è il reattivo precipitante, che ha il vantaggio, rispetto ai tradizionali metodi gravimetrici, di non introdurre elementi contaminanti nella soluzione in esame.
Questo metodo può essere applicato vantaggiosamente a numerosi metalli, come Cu, Ag, Zn, Sn, ecc. anche se la determinazione del Cu nelle sue leghe è una delle poche (se non l'unica) ancora in uso per analisi industriali di routine, caratterizzate da una buona sensibilità ed accuratezza.
L'elettrogravimetria permette, in alcuni casi, di realizzare delle separazioni tra metalli, depositando in modo selettivo e successivo vari elementi sullo stesso catodo. E' adatta all'analisi di soluzioni non molto diluite (provenienti per es. dall'attacco di leghe metalliche); non è invece adatta all'analisi di elementi in tracce. Richiede generalmente tempi di analisi medio-lumghi.
La d.d.p. da applicare agli elettrodi, cioè la tensione di scarica effettiva Ve può essere valutata sulla base del potenziale dell'elemento da scaricare (utilizzando la serie elettrochimica e l'equazione di Nerst), tenendo conto delle possibili sovratensioni.
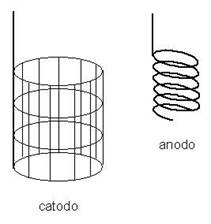
Gli elettrodi più utilizzati sono la coppia di elettrodi di Winkler: si tratta di una coppia di elettrodi di Pt: il catodo a forma di cilindro con le pareti costituite da una reticella di Pt; l'anodo, a spirale, ruota all'interno del catodo. L'anodo rotante, posto all'interno del catodo, garantisce un adeguato mescolamento alla soluzione sottoposto ad elettrolisi, in cui i due elettrodi sono immersi, aumentando la velocità di diffusione degli ioni al catodo e riducendo quindi i tempi di esecuzione del processo.
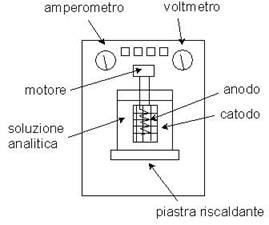
L'apparecchio che viene utilizzato, detto banco elettrolitico, permette anche il riscaldamento della soluzione, tramite una piastra riscaldante, sempre per ridurre i tempi dell'analisi. Si pesa inizialmente il catodo; quindi si immergono gli elettrodi nella soluzione e si collegano al banco elettrolitico, facendo passare corrente per un tempo opportuno: l’analita da dosare (per esempio il Cu contenuto in una soluzione derivante dall’attacco chimico di una lega di Cu, come bronzo o ottone) si riduce al catodo e si deposita sull’elettrodo.
Al termine del processo di elettrolisi, non si spegne subito l’apparecchio ma, con la tensione ancora applicata, occorre sollevare gli elettrodi dal becker in cui sono immersi, sostituire la soluzione con acqua distillata e solo a questo punto eliminare la d.d.p. applicata. Se l'interruzione di corrente si verificasse quando gli elettrodi sono ancora immersi nella soluzione analitica, si formerebbe una pila opposta e la sua forza controelettromotrice provocherebbe la ridissoluzione o il distacco del deposito dall'elettrodo.
In seguito si pesa nuovamente il catodo e dall’incremento di peso si risale alla quantità di analita scaricato. Dopo lavaggio con HNO3 concentrato, che rimuove il deposito elettrolitico, il catodo è pronto per una nuova determinazione quantitativa.
Applicando la tensione di scarica effettiva Ve, che tiene conto di tutti i fattori che intervengono nell'elettrolisi, il processo inizia con una adeguata velocità ma successivamente la velocità di scarica diminuisce, perché la scarica impoverisce la soluzione della specie elettroattiva e quindi si riduce nel tempo la corrente che attraversa la cella elettrolitica; ciò allungherebbe eccessivamente il tempo necessario per completare la scarica.
banco elettrolitico |
G: generatore di corrente continua A: amperometro R: reostato C: catodo A: anodo |
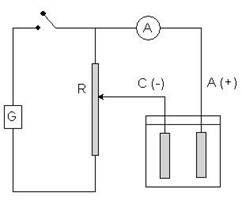 Per ovviare a questo inconveniente si può operare a i = costante, aumentando progressivamente nel corso dell'elettrolisi (specie nella parte finale), il potenziale applicato V, utilizzando l'apparecchio schematizzato. In tale apparecchio, per mezzo del reostato R, si può aumentare la d.d.p. agli elettrodi in modo programmato cioè tramite un motorino elettrico che fa scorrere il reostato sulla resistenza quando il valore della corrente i che passa nel circuito, misurato dall’amperometro A, è inferiore ad un valore prefissato dall’operatore. L'aumento progressivo di V compensa la diminuzione della velocità di scarica e quindi i tempi di elettrolisi rimangono contenuti a valori accettabili. Vi è tuttavia un inconveniente: occorre fare attenzione che il potenziale applicato non cresca fino a scaricare altri elementi presenti in soluzione, che potrebbero dare codeposizione, cioè scaricarsi insieme all'analita.
Per ovviare a questo inconveniente si può operare a i = costante, aumentando progressivamente nel corso dell'elettrolisi (specie nella parte finale), il potenziale applicato V, utilizzando l'apparecchio schematizzato. In tale apparecchio, per mezzo del reostato R, si può aumentare la d.d.p. agli elettrodi in modo programmato cioè tramite un motorino elettrico che fa scorrere il reostato sulla resistenza quando il valore della corrente i che passa nel circuito, misurato dall’amperometro A, è inferiore ad un valore prefissato dall’operatore. L'aumento progressivo di V compensa la diminuzione della velocità di scarica e quindi i tempi di elettrolisi rimangono contenuti a valori accettabili. Vi è tuttavia un inconveniente: occorre fare attenzione che il potenziale applicato non cresca fino a scaricare altri elementi presenti in soluzione, che potrebbero dare codeposizione, cioè scaricarsi insieme all'analita.
E' la tecnica più usata perché evita il rischio di codeposizioni di elementi indesiderati. In questo caso la cella elettrolitica contiene 3 elettrodi: l'anodo, il catodo su cui si avrà il deposito ed un terzo elettrodo di riferimento (a potenziale costante), posto vicino al catodo, che ha lo scopo di controllarne accuratamente il potenziale.
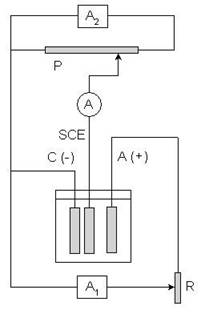 A1: alimentatore della cella elettrolitica A2: alimentatore del potenziostato
A1: alimentatore della cella elettrolitica A2: alimentatore del potenziostato
A: amperometro P: potenziometro C: catodo
A: anodo
SCE: elettrodo a calomelano saturo (riferimento) R: reostato
L'apparecchio che consente di realizzare una elettrolisi a potenziale controllato è detto potenziostato ed è schematizzato a fianco; si tratta di un banco elettrolitico abbinato ad un potenziometro, per il controllo del potenziale assunto dal catodo.
Quando l'apparecchio è in funzione, tramite l’amperometro A si legge il valore della corrente i che attraversa la cella elettrolitica, che deve rimanere superiore ad un valore prefissato, mentre ovviamente tenderebbe a diminuire nel tempo
Quando il valore della corrente i scende al di sotto del valore minimo, tramite il reostato R che si sposta sulla resistenza tramite un motorino elettrico, viene aumentata la d.d.p agli elettrodi ma agendo solo sul potenziale dell'anodo; il potenziale del catodo rimane costante e viene controllato in un campo di pochi mV tramite il potenziometro, la cui cella di misura è costituita dal catodo e da un elettrodo a potenziale costante (per esempio l'elettrodo SCE). In tal modo la corrente che attraversa la cella rimane pressoché costante ma anche il potenziale del catodo rimane rigorosamente invariato. Il continuo controllo esercitato sul potenziale assunto dal catodo permette di evitare fenomeni di scarica di elementi indesiderati e di codeposizione.
Fonte: http://www.webalice.it/claudio.casalino/files/Elettrolisi.pdf
Sito web da visitare: http://www.webalice.it/claudio.casalino
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve