I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
ENERGIA INTERNA DI UN GAS
L’energia interna è l'energia immagazzinata dalle particelle costituenti il sistema ed è uguale all'energia totale (cinetica + potenziale, cioè di interazione reciproca) di tutte le molecole che costituiscono il sistema.
Se il sistema è costituito da un gas perfetto l’energia associata ad ogni singola molecola è solo di tipo cinetico e non potenziale poiché le particelle che lo costituiscono non risentono di forze intermolecolari. L’energia cinetica di una molecola di un gas perfetto è data dalla relazione:
![]()
dove g è il numero dei gradi di libertà della particella. Una molecola può traslare nello spazio tridimensionale e ruotare: il moto di traslazione ha 3 gradi di libertà corrispondenti ai 3 assi dello spazio tridimensionale. Se la molecola è biatomica i gradi di libertà associati alla rotazione sono 2 mentre se è poliatomica sono 3. Le molecole biatomiche hanno solo 2 gradi di libertà rotazionale perché la rotazione attorno al proprio asse di non dà energia cinetica. Quindi:
Molecola |
Gradi di libertà |
Gradi di libertà |
Gradi di libertà Totali g |
Energia cinetica |
|
monoatomica |
3 |
0 |
3 |
|
|
biatomica |
3 |
2 |
5 |
|
|
poliatomica |
3 |
3 |
6 |
|
|
L’energia cinetica di una particella di massa m che si muove è anche data da:
![]()
Confrontando la (4) con la (5) otteniamo che la velocità di una molecola, che per semplicità considereremo monoatomica è data da:
![]()
Per avere un ordine di grandezza di queste velocità, possiamo considerare per esempio un atomo di idrogeno che si trova nell’aria in una giornata invernale; introducendo il valore della massa dell'idrogeno ad una temperatura di 0 °C, cioè 273 °K, otteniamo un valore per la velocità di 1506 m/ s ; questa è una velocità estremamente elevata; infatti il suono nell'aria ha una velocità di soli: 344m/s!
Da notare che non tutti gli atomi di idrogeno avranno questa velocità. Alcuni potranno essere più lenti mentre altri più veloci. La formula (6) è, in sostanza, una velocità media, anzi è la cosiddetta “velocità quadratica media”.
In particolare, le velocità di un gas che si trova ad una certa temperatura T seguono la cosiddetta legge delle velocità di Maxwell-Boltzmann il cui grafico è il seguente.
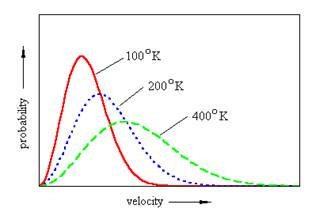
La velocità corrispondente al picco di ogni curva è la velocità più probabile definita dalla relazione:
![]()
![]()
La velocità di fuga dipende linearmente da R e meno da d, cioè conta di più le dimensioni di un pianeta piuttosto che la sua densità. Confrontando questa velocità con la (7) notiamo che la velocità di fuga che non dipende dalla massa delle molecole del gas è tanto più alta quanto più grande è la massa del pianeta.
Invece la velocità più probabile è tanto più grande quanto maggiore è la temperatura del pianeta e tanto più piccola quanto maggiore è la massa delle molecole.
Quindi le molecole fuggono con più facilità quanto più piccola è la massa del pianeta e quanto più alta è la sua temperatura. Ciò spiega come mai i pianeti giganti sono stati in grado di trattenere tutte i loro elementi, anche i più leggeri come idrogeno e elio, 90% H, 10% He. Per contrasto, i pianeti come la Terra hanno trattenuto solo i gas più pesanti come N e O.
La nube presolare era ricca di molecole di C e N che tende a formare metano e ammoniaca a basse temperature e alte pressioni, come nel caso dei pianeti giganti, e CO e N2 a relativamente alte temperature e basse pressioni, come nei pianeti di tipo terrestre.
![]()
In quest’ultima condizione il monossido di carbonio reagisce con l’acqua per formare anidride carbonica:
![]()
Fonte: http://www.fisicaweb.org/doc/gas/ENERGIA%20INTERNA%20DI%20UN%20GAS.doc
Sito web da visitare: http://www.fisicaweb.org
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve