I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Equilibrio chimico e massimo di entropia
In un miscuglio di gas ideali a 298 K, l’entropia di un singolo gas i che ne fa parte è:
Si = ni Si° – niRln pi ; lo stesso valore di entropia sarebbe posseduto dal gas che si trovasse da solo alla pressione pi nello stesso volume e alla stessa temperatura. ni Si° rappresenta invece l’entropia che avrebbe il gas se si trovasse da solo alla stessa pressione totale che ha il miscuglio di gas (per avere tale pressione maggiore di pi il gas i dovrebbe stare ovviamente in minor volume). Si° riferito a un’atmosfera si può ricavare dalle tabelle dell’entropia assoluta delle sostanze. Poiché pi = P·xi (dove P è la pressione totale del miscuglio e xi è la frazione molare del gas i) abbiamo:
Si = ni Si° – niRln P– niRln xi
la reazione da noi scelta avviene senza variazione di numero di moli, perciò in condizioni di idealità anche la pressione totale deve essere costante. Se scegliamo di seguire la reazione alla pressione costate di 1 atm, si ha lnP = 0 e l’espressione diventa: Si = ni Si°– niRln xi. Poiché la frazione molare xi è minore di 1, si ottiene che il termine – niRln xi è positivo, ovvero l’entropia che ha un gas in miscela è maggiore di quella che avrebbe la stessa quantità di gas i se si trovasse da solo alla stessa pressione del miscuglio.
Nella situazione iniziale abbiamo:
S1 = SH2°+ SI2° – R ln – R ln = SH2° + SI2° + R ln 4
Nella situazione finale, invece,
S2 = (1-e)SH2°+ (1-e)SI2° + 2e SHI° – (1-e)R ln xH2 – (1-e)R ln xI2 – 2eR ln xHI ;
Sottraendo S1 da S2 abbiamo la variazione di entropia del sistema che si trasforma per la frazione e:
DS = e (2 SHI° – SH2° – SI2°) – (1-e) R ln xH2 – (1-e) R ln xI2–2e R ln xHI– R ln 4.
Il termine (2 SHI° – SH2° – SI2°), corrispondente alla differenza tra le entropie dei prodotti e dei reagenti, può essere riassunto con la simbologia DrS°. Separiamo i termini proporzionali ad e:
DS = eDrS° - e R (-ln xH2 - ln xI2 + ln xHI 2) - R (ln xH2 + ln xI2 + ln4)
Raggruppiamo ora i logaritmi:
DS = eDrS° - e R ln - R ln (4 xH2 xI2 ) ; abbiamo così ottenuto DS come funzione di e .
Per ricavare il DS dell’universo dobbiamo ora considerare che la reazione effettiva, a differenza di quella reversibile, avviene attraverso la rottura e la formazione di legami chimici. La cosa comporta uno scambio di calore con l’ambiente esterno, necessario per ristabilire la temperatura di 298 K. Nel caso reversibile, in cui i reagenti non si trasformano nei prodotti, ma sono estratti reversibilmente dal sistema, mentre il prodotto HI non si forma nel sistema, ma entra reversibilmente attraverso una membrana semipermeabile, le variazioni di entropia dell’ambiente sono uguali, a meno di una differenza infinitesimale, a quelle del sistema, e di segno opposto. Il risultato ci darebbe una variazione DSu = 0, che non ci interessa molto. Nel caso reale, in cui la reazione raggiungesse un grado di avanzamento irreversibile e, la variazione di entropia del sistema coinciderà con quella giù calcolata per il caso reversibile (perché S è una funzione di stato). Il DSa “vero” dell’ambiente, invece, deve corrispondere al calore ad esso trasmesso nella reazione “vera” e irreversibile, diviso T (298). Il calore assorbito dal termostato ha segno contrario alla variazione di entalpia DrH del sistema, che equivale alla frazione e del DrH° (ottenibile dalla differenza tra le entalpie di formazione del prodotto meno quelle dei reagenti):
DSa = -
A questo punto la variazione di entropia dell’universo, DSu, si ottiene sommando DSa e DS
DSu = - + eDrS° - e R ln - R ln (4 xH2 xI2 ).
Dalle tabelle ricaviamo i dati sperimentali delle entropie assolute e delle entalpie di formazione di H2(g), I2(g) e HI(g) , esplicitiamo DSu come funzione di e e grafichiamo il risultato ottenuto.
|
H2(g) |
I2(g) |
HI(g) |
S° |
130,6 J/(K·mol) |
260,6 J/(K·mol) |
206,5 J/(K·mol) |
DfH° |
0 |
62,34 |
26,48 kJ/mol |
L’entalpia di formazione di I2(g) non è zero poiché a 298 K e 1 atm lo stato più stabile di tale elemento è quello solido. 62,34 kJ/mol corrispondono all’entalpia di sublimazione dello iodio.
Dalla tabella si ricava DrS° = + 21,8 J/(K·mol) e DrH° = - 9380 J/mol. In definitiva la nostra funzione è:
DSu(e) = 53,3e -e 8,31 ln - 8,31 ln (1- e)2
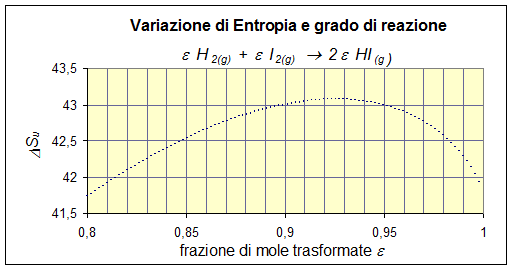
Con un massimo a e = 0,925. Si tratta, evidentemente, di una reazione spostata a destra, con un’alta costante d’equilibrio.
Calcolare il massimo della curva per via analitica sarebbe estremamente complicato, poiché la derivata sarebbe una funzione di quinto grado e logaritmica, risolvibile solo graficamente. A questo punto tanto varrebbe trovare per tentativi o per via grafica il massimo direttamente sulla curva, anziché sulla sua derivata (in questo modo si ottiene il valore emax = 0,925).
Ma si può ugualmente ricercare il massimo in modo esatto ricorrendo a uno stratagemma: considerare trascurabili le variazioni dei logaritmi per piccole variazioni di e . In tal caso la derivata della funzione DSu(e) è semplicemente:
= +53,3 - 8,31 ln ; chiamando R il rapporto che sta all’argomento del logaritmo e uguagliando a zero la derivata, otteniamo 53,3 - 8,31 lnR = 0; ma qualora l’entropia raggiungesse un massimo, la reazione non potrebbe procedere oltre in modo spontaneo, poiché avrebbe raggiunto lo stato di equilibrio. Quindi in tale condizione il rapporto R, ottenuto sostituendo e nell’equazione , equivale alla costante d’equilibrio Kx. Abbiamo dunque:
ln Kx = , da cui Kx = ![]() = 610;
= 610;
Sapendo che Kx = = 610 si può ricavare facilmente emax estraendo prima la radice quadrata: = 24,7, da cui 2emax = 24,7– 24,7·emax;
emax(2+24,7) =24,7
emax = 24,7/26,7 = 0,925. La perfetta corrispondenza di questo valore con quello ricavato per via grafica conferma la validità della nostra procedura e del valore trovato per la costante Kx.
Non è difficile generalizzare questo risultato e metodo di calcolo della costante d’equilibrio ad una reazione qualsiasi. Anziché ricercare il valore di DS per tutti i valori di e di una reazione (lavorando sulla funzione primitiva) il problema si può semplificare ricavando direttamente il differenziale della funzione, dS, che risulta proporzionale a de, e imponendo che esso si annulli (il che equivale a cercare l’estremo).
Lo spostamento infinitesimo de è a partire da una situazione iniziale in cui ci sono tutti i reagenti e i prodotti:
S1 = nH2 SH2°+ nI2 SI2° – nHI S°HI + nH2 R ln pH2 – nI2R ln pI2 – nHIR ln pHI
Nella situazione finale, invece,
S2 = (nH2 -de)SH2°+ (nI2 - de)SI2° + (nHI + 2de) S°HI– (nH2 - de)R ln pH2 – (nI2 - de)R ln pI2 – (nHI + 2de)R ln pHI ;
Non ci deve sfuggire un’approssimazione: i valori delle pressioni parziali dello stato 2 sono leggermente diversi da quelli dello stato 1, ma se de è realmente << 1 tale differenza può essere trascurata.
Sottraendo S1 da S2 abbiamo la variazione di entropia dS del sistema che si trasforma per la frazione de:
dS = deDrS° - de R ln
Sommiamo il dSa dell’ambiente, pari - de , e otteniamo
dSu = de (DrS° - ) - de R ln
Se indichiamo la quantità tra parentesi con DrSu°, la variazione infinitesima di entropia, associata alla trasformazione chimica di de moli di reagenti in prodotti, sarà espressa semplicemente da:
dSu = de (DrSu° - R ln)
Nella parentesi abbiamo la funzione derivata dell’entropia dell’universo rispetto al grado di reazione. Facendo riferimento al grafico della funzione primitiva, il dSu, a seconda della situazione in cui ci troviamo (determinata dalle pressioni parziali con cui mettiamo i tre gas nel sistema) può assumere tre valori: positivo (fase crescente, parte sinistra della curva a campana), nullo (piccoli spostamenti a destra o a sinistra intorno al punto di massimo) o negativo (zona decrescente all’estremità destra della curva). Esaminiamo il significato dei tre casi.
Se ci troviamo con dSu>0 ciò significa che la formazione di altri prodotti e la scomparsa di un po’ di reagenti avverrà in modo spontaneo, con aumento dell’entropia, ovvero ci troviamo ancora a “sinistra” dello stato di equilibrio, lungo la coordinata di reazione.
Se invece dSu = 0 vuol dire che la reazione può avvenire anche reversibilmente, il che sta a significare che siamo all’equilibrio e anche al punto finale della trasformazione, dato che l’entropia non potrà ulteriormente aumentare: il processo “è morto”. Questo si ha quando la combinazione di pressioni parziali è tale che:
ln = ovvero Ke = =![]()
![]()
Dove Ke è la costante d’equilibrio.
Infine, se dSu < 0 vuol dire che la formazione di ulteriori prodotti contraddirebbe il secondo principio della termodinamica e quindi non si potrebbe mai verificare. Le pressioni parziali dei tre gas, con cui abbiamo “caricato” il sistema, corrispondono a uno stato situato oltre lo stato d’equilibrio. Cosa accadrà allora? Se la trasformazione con de comporta diminuzione dell’entropia (discende la “collina”), la trasformazione opposta -de, in cui un po' di prodotto riforma un po’ di reagenti (risalendo verso la sommità della collina), avrà un dSu>0. In poche parole se ci troviamo oltre la posizione dell’equilibrio, avverrà la reazione opposta fino a raggiungere l’equilibrio. Tale trasformazione sarà spontanea e irreversibile, proprio come quella che dai reagenti conduce all’equilibrio.
Una nuova funzione di stato (l’ultima, promesso)
Esplicitando la variazione DrSu abbiamo DrSu = -DrH/T + DrS, . Osserviamo che ciò che accade all’entropia dei due sottosistemi (quello in cui avviene la reazione chimica e il termostato) è espresso in realtà solo in funzione di ciò che accade al sistema, poiché DrH , T, e -DrS sono variabili e funzioni proprie del sistema. Questa è una bella notizia, poiché possiamo sperare di trovare una forma del secondo principio che ci faccia prevedere in quale direzione il sistema deve evolvere senza dover considerare “tutto l’universo”. Né l’entropia né l’entalpia del sistema, da sole, ci danno tale criterio, poiché ciascuna delle due può altrettanto bene aumentare o diminuire nelle trasformazioni spontanee, a seconda dei casi. Questa particolare combinazione delle due grandezze, S - H/T, invece, aumenta sempre quando il sistema chimico evolve rimanendo in equilibrio meccanico e termico con il suo ambiente. Poiché l’energia ci sta più simpatica dell’entropia, moltiplichiamo tutto per T, ottenendo così grandezze energetiche: TDrSu = -DrH + TDrS; inoltre, dato che l’energia deve tendere a un minimo, e non a un massimo come fa Su, cambiamo il segno:
-TDrSu = DrH - TDrS = Dr(H –TS) = DrG
Dove G = H – TS è una funzione di stato (non occorre dimostrarlo, dato che H, T ed S lo sono) chiamata energia libera o funzione di Gibbs . Data la relazione tra DrSu e DrG, dire che l’entropia dell’universo deve sempre aumentare in un processo naturale, equivale a dire che l’energia libera del sistema deve diminuire sotto i vincoli della temperatura e della pressione costanti. Se un sistema chiuso potesse solo scambiare calore e lavoro di espansione contro una pressione esterna, le condizioni di equilibrio meccanico e termico starebbero a indicare che tale sistema si trova già all’equilibrio e che l’entropia non potrebbe in alcun modo aumentare, come dire che il sistema non potrebbe più trasformarsi. Ma esiste una terza fonte di irreversibilità, chiamata irreversibilità chimica. Come l’irreversibilità meccanica è il risultato dello sbilanciamento delle pressioni interna ed esterna, l’irreversibilità termica risulta da differenze di temperatura tra sistema e ambiente, l’irreversibilità chimica risulta dalla differenza di “potenziale chimico”, m, tra reagenti e prodotti. P, T e m (mu) sono tre variabili intensive, che moltiplicate per la variazione di una determinata grandezza estensiva, producono una variazione di energia “in uscita” dal sistema.
-T·DS = -Qrev (minima quantità di calore che esce dal sistema in un’ipotetica trasf. reversibile)
P·DV = Lesp (lavoro di espansione massimo, che comporta perdita di energia del sistema)
-mi·Dni = Lch lavoro chimico in uscita, dovuto al consumo della sostanza i (da cui il segno -), che può essere sfruttato per generare sostanze complesse (a bassa entropia, es. cellulosa) o instabili (ad elevata entalpia, es. ATP) o trasformato in lavoro elettrico in un adatto dispositivo (pila). Abbiamo già introdotto nell’equazione WISE il potenziale chimico m come grandezza intensiva, il cui “sbilanciamento”comporta una spinta a causare una trasformazione chimica irreversibile così come uno scompenso tra pressione interna ed esterna comporta un’espansione o una compressione irreversibili.
Il primo principio della termodinamica si può scrivere ricavando la variazione dell’energia del sistema come somma di tre contributi: DE = Q - Lesp – Lch, dove si è separato il lavoro di espansione dal lavoro chimico (in sistemi più complessi potrebbero esserci altre forme di lavoro, come quello magnetico o dalle interazioni superficiali, ma qui non li prendiamo in considerazione poiché ci occupiamo di termodinamica chimica). È importante notare che in una trasformazione spontanea e irreversibile Q > Qrev. Quindi possiamo scrivere Q = Qrev + Qdis, dove Qdis è un surplus di calore dissipato, o “energia sprecata”, negativa per definizione (cioè positiva per l’ambiente).
DE = Qrev + Qdis - Les – Lch. Sapendo che Lesp = PeDV e Qrev= TDS, mettendoci in condizioni di equilibrio termico e meccanico (il che non significa che la trasformazione sia reversibile), avremo
DE = TDS + Qdis - PDV – Lch
Ricordando la definizione di H = E + PV, e portando PDV al primo membro, avremo, a P e T costanti:
DH = TDS + Qdis– Lch
Portando anche TDS al primo membro, e ricordando la definizione di G appena introdotta, si conclude che:
DG = Qdis– Lch
Ovvero: la diminuzione di energia libera che si ha in un processo spontaneo si ripartisce tra una liberazione di calore all’esterno del sistema e la produzione di lavoro chimico o lavoro “utile”. Se il processo è condotto in condizioni di quasi reversibilità chimica, oltre che termica e meccanica, avremo Q » Qrev e Qdis » 0, ovvero la diminuzione di energia libera si traduce nella massima quantità possibile di lavoro chimico prodotto o accumulato:
DG = – LUmax
Tutte le trasformazioni chimiche tendono al massimo grado di disordine nelle posizioni delle molecole e delle loro distribuzioni di energia (massima S) e nel contempo tendono alla formazione di legami più stabili (minima H). Da questa “spinta”, se togliamo l’energia che viene sprecata per riscaldare il mondo circostante e quella che si traduce in un banale aumento di volume contro la pressione esterna, quanta ne rimane per fare qualcosa di utile? La risposta è semplice: - DG.
E se noi non introduciamo alcun dispositivo o sistema di catalisi atto a sfruttare tale lavoro chimico, immagazzinandolo in legami chimici, o trasformandolo in lavoro utile? Allora andrà tutto sprecato, andremo ad aumentare la frazione Qdis e avremo DG = Qdis, che è come dire che l’entropia dell’universo aumenterà della quantità Qdis/T. L’energia libera è una funzione di stato: per una data reazione che avviene tra uno stato iniziale e uno finale, DG non cambia. Se c’è un dispositivo (es. pila) o un sistema di catalizzatori e stadi intermedi di reazione, ci potremo avvicinare alla reversibilità, con processi di trasformazione non troppo lontani dall’equilibrio, con minore dissipazione e massimo rendimento in utilizzo. Se non mettiamo alcunché e lasciamo che la reazione avvenga in tutta la sua irrefrenabile irreversibilità, avremo il massimo aumento di entropia dell’universo, con lo stesso DG del sistema. In effetti, mentre G è una funzione di stato, TDSu può assumere valori diversi per uno stesso DG, a seconda di come si effettua la trasformazione del sistema e ciò si verifica perché nell’ambiente i cambiamenti sono differenti a seconda delle diverse modalità con cui portiamo il sistema dallo stato iniziale a quello finale. Ma allora che dire dell’equazione -TDrSu = DrG ? Essa sembra stabilire un rapporto rigido e ben preciso tra DG e DSu, cioè, una volta fissato DG, il DSu sarà determinato. E così è, ma questo si verifica perché nelle nostre “scatole di van’t Hoff non abbiamo previsto nessuna forma di opposizione al potenziale chimico e quindi nessuna forma di lavoro utile. Se esaminiamo la questione più in dettaglio possiamo risolvere questa contraddizione.
DSu = DS – (dove il secondo termine a destra è il DSa)
TDSu = TDS – Q
Sostituiamo Q = DE + L e dividiamo il lavoro in lavoro PDV e altre forme “utili”.
TDSu = TDS – DE – PDV + Lu;
sostituiamo DH = DE – PDV (a pressione costante)
TDSu = TDS – DH + Lu;
sostituiamo DG = DH - TDS
TDSu = –DG + Lu; che è un’espressione più completa di quella ottenuta con le dette “scatole”.
Se DSu > 0 => -DG – Lu > 0 à DG + Lu > 0 à Lu < -DG
Se DSu = 0 => -DG – Lu = 0 à Lu = Lmax = -DG
Dobbiamo ammettere che la trasformazione chimica, da un dato stato iniziale a un dato stato finale, ha un determinato DG, ma può essere fatta a vari gradi di irreversibilità. Il massimo grado si ha quando Lu = 0 e TDSu = -DG , cioè tutto il lavoro che si sarebbe potuto ottenere è stato dissipato. Se non si sfrutta il lavoro extra, il processo sarà completamente spontaneo. Se lo si vuole sfruttare si deve contrastare la terza causa di irreversibilità: quella chimica, ottenendo quindi un processo reversibile. Nell’elettrochimica vedremo come ciò si possa fare praticamente.
Nel frattempo rimettiamo in gioco la cosiddetta “Isoterma di van’t Hoff”:
dSu = de (DrS° - ) - de R ln
Poniamo de = 1 mol. Come può una quantità infinitesima essere pari a una mole? Lo è se nella grande scatola ci sono dieci milioni di moli a determinare le pressioni dei vari gas. Dopo la reazione di una mole, in pratica, nessuna pressione sarà cambiata significativamente. L’isoterma di van’t Hoff diventa:
DSu = DrS° - - R ln
Moltiplicando per T abbiamo:
TDSu = - DG = TDrS° -DrH° - RT ln , cioè:
- DG = -DrG° - RT ln
DrG = DrG° + RT ln
Isoterma di van’t Hoff
L’argomento del logaritmo si annulla, ad esempio, se tutte le pressioni sono scelte con valore unitario, qualunque sia la reazione. In tal caso DrG° = DG, il che definisce DrG° (facilmente calcolabile dai valori tabulati) come la variazione di energia libera che si ha nella trasformazione di una mole di reagenti in prodotti mantenendo pressioni parziali unitarie e costanti di tutti i componenti..
Lo stato con Rp = 1 è equidistante, lungo la coordinata di reazione, dai reagenti e dai prodotti. Questo viene rappresentato dal trattino centrale lungo l’asse delle ascisse. Si ricava dalla curva la variazione di G che corrisponde alla trasformazione di una mole di reagenti in prodotti (freccia orizzontale verso destra, De = +1).
Nella reazione a sinistra si ottiene un valore positivo del DrG° perché lo stato con Rp = 1 si trova nel tratto crescente della curva, ovvero in una situazione in cui le concentrazioni di prodotti eccedono quelle dello stato d’equilibrio che, per questa particolare reazione, risulta spostato verso i reagenti.
Nella reazione di destra lo stato con Rp = 1 corrisponde al ramo decrescente della curva, il DrG° è negativo, cioè l’equilibrio si trova più a destra di tale stato, spostato verso i prodotti. Quindi dal segno di DrG° possiamo ricavare:
DrG° > 0 reazione “poco favorita o endoergonica”, spostata a sinistra, Ke < 1
DrG° < 0 reazione “favorita o esoergonica”, spostata a destra, Ke > 1
Non dobbiamo compiere l’errore di affermare che una reazione con DrG° positivo non potrà avvenire spontaneamente. Non è vero: tutte le reazioni procedono fino all’equilibrio. Unendo i reagenti questi si trasformeranno nei prodotti fino a raggiungere le concentrazioni, o pressioni parziali, previste dall’equilibrio. Lo stesso accade se DrG° è negativo, con la differenza che all’equilibrio, in questo caso, ci saranno concentrazioni di prodotti maggiori rispetto ai reagenti.
Se volessimo conoscere DrG per uno stato con pressioni parziali qualsiasi, anziché tutte unitarie, dovremmo utilizzare l’isoterma di reazione completa e, ovviamente, conoscere le concentrazioni o le pressioni parziali per sostituirle nell’argomento del logaritmo, Rp. Anche in questo caso, se la combinazione di pressioni corrisponde ad uno stato posto più a sinistra dell’equilibrio, avremo DrG < 0, ovvero Rp < Kp; se è posto a destra dell’equilibrio sarà DrG > 0, Rp > Kp. Se invece DG risultasse nullo, ciò significherebbe che le concentrazioni o pressioni scelte corrisponderebbero a uno stato d’equilibrio, Rp = Kp.
Notiamo che tutto ciò differisce da DrSu°, costante, solamente per il termine -RlnRp, (dove Rp è il rapporto delle pressioni parziali elevate ai rispettivi coefficienti stechiometrici). Poiché tale termine è scaturito dalla somma delle variazioni dell’entropia di miscela di tutti i componenti, possiamo ora pienamente apprezzare che l’esistenza di uno stato di equilibrio e della stessa costante d’equilibrio sono legate a tale modo di incrementare l’entropia.
Introdotta da Josiah Willard Gibbs, pronuncia “ghibs” (che non è uno dei fratelli Gibb dei Bee Gees, ma lo scienziato americano che ha dimostrato ed enunciato il “teorema di Gibbs”, in base al quale l’entropia di un gas in miscela è la stessa che quel gas avrebbe se occupasse da solo lo stesso recipiente e in base al quale siamo stati in grado di calcolare l’entropia di miscela.
Si potrebbe obbiettare che Su, essendo somma delle funzioni di stato S e Sa, dovrebbe essere anch’esso una funzione di stato, con variazioni indipendenti dal percorso. Questo sarebbe vero se considerassimo il sistema “intero” o isolato come sistema. Ma in tal caso una trasformazione reversibile e una irreversibile non potrebbero avere ambedue gli stessi stati iniziale e finale.
Fonte: http://www.divini.net/chimica/materiali/chimicafisica/Equilibrio%20chimico%20e%20massimo%20di%20entropia.doc
Sito web da visitare: http://www.divini.net
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve