I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
EQUILIBRI ACIDO-BASE IN SOLUZIONE ACQUOSA
pH
La relazione:
pH = - log {H+}
permetterebbe di calcolare il pH se fosse nota l’attività degli ioni H+.
Di fatto il pH viene misurato per via strumentale mediante pH-metri.
Per questo motivo del pH si deve dare una definizione operazionale.
Tuttavia, possiamo stimare il pH e la sua dipendenza da variabili quali la concentrazione analitica c (g mol-1) e le costanti degli equilibri in soluzione, almeno nel caso di soluzioni ideali (diluite), per le quali:
{H+} = [H+]
DEFINIZIONE DI ACIDO E BASE IN SOLUZIONE ACQUOSA
Definizione di Bronsted
Un acido HA è un donatore di protoni.
Una base B è un accettore di protoni.
Un acido può manifestare la sua capacità di cedere protoni solo in presenza di una base:
HA + B = A_ + BH+
COSTANTI DI DISSOCIAZIONE DI ACIDI E BASI IN ACQUA
HA + H2O = H3O+ + A_
è governato dalla costante termodinamica di dissociazione acida:

B + H2O = BH+ + OH_
è governato dalla costante termodinamica di dissociazione basica:
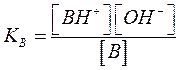
La molarità dell’acqua è inglobata nelle costanti.
H2O = H+ + OH_
è governato dalla costante KW (prodotto ionico dell’acqua):
![]() = 10-14
= 10-14
da cui: pH + pOH = 14
![]()
cioè: pKA + pKB = 14
Fonte: http://www.uniroma2.it/didattica/Chimica_Analitica_I/deposito/Chimica_Analitica_I_+_Lab.doc
Sito web da visitare: http://www.uniroma2.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve