I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Norme generali di comportamento in laboratorio
Consultare i manuali sul rischio chimico a disposizione in laboratorio.
Prima di entrare in laboratorio
L’attività nel laboratorio chimico presenta un certo rischio che può essere molto ridotto seguendo le norme di sicurezza e operando con attenzione.
È indispensabile sapere che cosa si va a fare in laboratorio.
Per questo motivo ogni studente, usando questo compendio, dovrà studiare con cura l’esperienza che eseguirà.
Lo studente che non conosce l’esperienza che deve eseguire costituisce un pericolo per sé e per gli altri.
Comportamento in laboratorio
Prima di andare via
Esperienze del Gruppo A
Esposizione delle esperienze Gruppo A
Esperienze A-1
Polarità, proprietà fisiche e punto di fusione
Effetto della polarità sulle proprietà fisiche
Determinazione del punto di fusione
Esperienze A-2
Purificazione di composti organici
Cristallizzazione semplice
Grado alcolico del vino con l’ebulliometro di Malligand
Esperienze A-3
Separazione per distillazione
Distillazione semplice
Distillazione con colonna di frazionamento
Esperienza A-1
Polarità, proprietà fisiche e punto di fusione.
Questa esperienza ha lo scopo di illustrare allo studente come le proprietà polari dei composti organici ne influenzino le caratteristiche fisiche e, in special modo, la solubilità, la densità e la volatilità. La determinazione del punto di fusione, fornisce allo studente un metodo analitico semplice per stabilire l’identità di un composto chimico e gli permette di rendersi conto che la purezza dello stesso influisce sulle sue caratteristiche fisiche.
Inoltre lo studente ha il primo contatto con pezzi di vetreria semplice e di apparecchi da laboratorio.
Lo studente eseguirà le seguenti prove.
Per verificare l’effetto della polarità sulle proprietà fisiche, miscelerà a due a due i solventi assegnati verificando se c’è miscelazione o separazione dei liquidi e, in questo caso, quale liquido sarà sul fondo. Nella seconda parte della prova verificherà in quale solvente si sciolgono o no NaCl, saccarosio e 2-naftolo.
Determinazione del punto di fusione di tre sostanze di purezza commerciale e riconoscimento delle stesse sulla base del punto di fusione riportato in letteratura. Determinazione del punto di fusione misto.
Effetto della polarità sulle proprietà fisiche
Obiettivo:
Determinare la solubilità di solventi e di soluti
Prerequisiti:
Concetto di polarità e di solubilità
Materiali e attrezzature:
Vetreria |
Bacchette di vetro Becher da 250 mL Beute da 100 mL Mortaio con pestello Pipette Pasteur con tettarella Provette da 15 cm Vetrini d’orologio diam. 6 cm |
Materiale di consumo |
Acqua distillata Etanolo Acetone Cloroformio Etere di petrolio 40/60 NaCl 2-Naftolo Saccarosio |
Varie |
Fornelli elettrici con agitazione Portaprovette Spatole |
Procedimento
In una serie di provette, miscelerà a due a due i solventi assegnati, agiterà la miscela con una bacchetta di vetro e descriverà i fenomeni osservati. In particolare descriverà se c’è miscelazione o separazione dei liquidi e, in questo caso, quale liquido sarà sul fondo.
Successivamente preparerà tre serie di provette contenenti circa 2 mL di ciascuno dei solventi assegnati. In una serie verserà una piccola quantità di NaCl, nella seconda una piccola quantità di saccarosio e nella terza una piccola quantità di 2-naftolo. Dopo aver agitato con la bacchetta di vetro, riscaldato in bagno d’acqua e fatto raffreddare, descriverà i fenomeni osservati. In particolare quali solventi sciolgono o non sciolgono le tre sostanze solide. Alla fine porrà in relazione struttura e proprietà fisiche dei solventi e dei soluti.
Determinazione del punto di fusione
Obiettivo:
Determinare il punto di fusione di sostanze pure e impure
Prerequisiti:
Concetto di polarità e di punto di fusione
Materiali e attrezzature:
Strumentazione |
Apparecchi per punto di fusione (almeno 2) |
Vetreria |
Capillari di vetro per punto di fusione Mortaio con pestello Tubo di vetro (100 x 1 cm) Vetrini d’orologio diam. 6 cm |
Materiale di consumo |
Acetanilide (p.f. 115 °C) Acido Benzoico (p.f. 122 °C) Urea (p.f. 133 °C) Incognito |
Varie |
Spatole |
Procedimento:
La determinazione del punto di fusione di un composto avviene ricreando, nell’apparecchio per il punto di fusione, le condizioni in cui quella sostanza passa dallo stato solido a quello liquido. L’apparecchio è costituito da un blocco metallico riscaldato elettricamente e munito di fori per l’introduzione del termometro e dei capillari.
Il campione, finemente polverizzato nel mortaio, viene introdotto nel capillare con l’aiuto di una spatola e fatto compattare sul fondo picchiando il capillare sul banco o con l’aiuto di un tubo di vetro di circa un metro. È sufficiente un strato di 2-3 mm. Il capillare si introduce nell’apposito foro dell’apparecchio e, mediante il reostato, si fa salire la temperatura del blocco metallico. Durante il riscaldamento è molto importante tenere bene d’occhio il termometro e la sostanza per evitare di perdere il momento in cui la sostanza fonde.
Di norma, se il campione è incognito, si eseguono due determinazioni: la prima, più rapida e approssimata, serve per determinare l’ordine di grandezza della temperatura da determinare. Nella seconda prova, invece, si scalda con rapidità fino a circa 20° meno della temperatura supposta, poi si continua a riscaldare con un incremento di circa 2° al minuto, rilevando con attenzione la temperatura a cui inizia la fusione e quella a cui ha termine. Se la sostanza organica è pura, tale intervallo risulta non superiore a 1-2 °C.
Da questo dato sperimentale è possibile determinare se il campione analizzate è puro oppure è costituito da una miscela.
Per confronto con dati presenti in tabelle è possibile confermare o escludere l’identità della sostanza in esame.
Lo studente dopo aver misurato il punto di fusione dei tre composti noti, misurerà anche quello del campione incognito. Riconoscerà il campione incognito per confronto fra il suo punto di fusione e quello dei tre composti noti e, infine, confermerà il riconoscimento effettuando una misura del punto di fusione misto.
Osservazioni
Da notare che nel caso una sostanza non sia pura il suo punto di fusione diminuisce.
Valutazione del rischio
Rischio chimico
Reagenti liquidi: etanolo; acetone; cloroformio; etere di petrolio 40/60
Rischio moderato. Volatilità. Infiammabilità. Usare sotto cappa.
Reattivo: 2-naftolo
Pericolosità: Irritante. Rischio moderato.
Maneggiare con i guanti.
Reattivo: Acetanilide
Pericolosità: Irritante. Rischio moderato.
Maneggiare con i guanti.
Reattivo: Acido benzoico
Pericolosità: Irritante. Rischio moderato.
Maneggiare con i guanti.
Reattivo: Urea
Pericolosità: Minima. Rischio minimo.
Maneggiare con i guanti.
Reattivio: Saccarosio, NaCl;
Rischio nullo
Altri tipi di rischio
Apparecchi elettrici. Vetreria di laboratorio.
Rischio moderato. Pericolo di scottature. Maneggiare con precauzione.
Esperienza A-2
Purificazione di composti organici.
Cristallizzazione semplice. Grado alcolico del vino con l’ebulliometro di Malligand.
Questa esperienza ha lo scopo di illustrare allo studente i primi rudimenti dei metodi di purificazione delle sostanze organiche e di come sia necessario una procedura di controllo della purezza stessa. Con la determinazione del grado alcolico del vino, lo studente ha un’esperienze pratica di quanto ha finora appreso per via teorica.
Lo studente eseguirà le seguenti prove.
Determinazione del punto di fusione di una sostanza commerciale opportunamente “inquinata” in modo da abbassarne la purezza, purificazione della stessa mediante cristallizzazione in opportuno solvente e trattamento con carbone decolorante. Recupero della sostanza cristallizzata e determinazione del punto di fusione per controllare l’incremento della purezza. Riconoscimento della sostanza sulla base del punto di fusione riportato in letteratura e controllo mediante determinazione del punto di fusione misto.
Determinerà poi il grado alcolico del vino mediante l’uso dell’ebulliometro di Malligand
Cristallizzazione semplice
Obiettivo:
Purificare una sostanza inquinata mediante cristallizzazione e verificarne la purezza con il punto di fusione.
Prerequisiti:
Concetto di punto di fusione.
Principi fisici dei passaggi di stato.
Materiali e attrezzature:
Strumenti di misura |
Apparecchio per punto di fusione |
Vetreria |
Bacchette di vetro Becher 250 mL Beuta da vuoto da 250 mL Beute da 250 mL Capillari di vetro per punto di fusione Imbuti di vetro diam. 6 cm Imbuto di Buchner diam. 6 cm Tubo di vetro (100 x 1 cm) Vetrini d’orologio diametro 6 cm |
Materiale di consumo |
Acetanilide (p.f. 115 °C) Carbone decolorante Acqua distillata |
Varie |
Ancoretta magnetica Anello di gomma per buchner Asta di sostegno per imbuto Carta da filtro Forbici Frammenti di pomice o ceramica per distillazione Pompa da vuoto Portaimbuto ad anello Riscaldatore elettrico con agitazione Spatola |
Procedimento:
Per prima cosa si verifica il punto di fusione della sostanza da purificare. Poi se ne pesano 2 g in una beuta da 250 mL, si aggiungono 100 mL di acqua distillata, un’ancoretta magnetica e si pone sul fornello agitatore fino all’ebollizione. Quando tutto il materiale si è sciolto, si aggiunge con precauzione una spatolata di carbone decolorante, si lascia di nuovo raggiungere l’ebollizione. Si filtra con un filtro a pieghe dopo aver riscaldato l’imbuto con acqua calda e si raccoglie il filtrato in una beuta. Si lascia cristallizzare e si filtra alla pompa da vuoto. Si asciugano bene i cristalli e si verifica di nuovo il punto di fusione.
Osservazioni
E’ opportuno aggiungere il carbone a piccole quantità agitando continuamente e dopo aver tolto la beuta dal fornello.
Grado alcolico del vino con l’ebulliometro di Malligand
Obiettivo:
Determinare il grado alcolico del vino.
Prerequisiti:
Concetto di temperatura di ebollizione.
Principi fisici dei passaggi di stato.
Materiali e attrezzature:
Strumenti di misura |
Ebulliometro di Malligand |
Vetreria |
Becher 100 mL |
Materiale di consumo |
Vino Acqua distillata |
Procedimento:
Si versa acqua distillata nell’ebulliometro fino alla prima tacca. Si rimonta l’apparecchio si accende il fornello e si aspetta che l’acqua raggiunga l’ebollizione e si blocca la cremagliera nella posizione raggiunta dal menisco del mercurio nel termometro. Si elimina l’acqua, si lascia raffreddare e si versa il vino fino alla seconda tacca. Si rimonta l’apparecchio, si riempie d’acqua il refrigerante, si accende il fornello e si osserva il menisco del mercurio. Si posiziona il cursore alla massima temperatura segnata dal menisco e si legge il grado alcolico.
Osservazioni
Per poter osservare agevolmente il menisco del mercurio occorre una forte illuminazione.
Valutazione del rischio
Rischio chimico
Reattivo: Acetanilide
Pericolosità: Irritante. Rischio moderato
Maneggiare con guanti.
Altri tipi di rischio
Apparecchi elettrici. Vetreria di laboratorio.
Rischio moderato. Pericolo di scottature. Maneggiare con precauzione.
Esperienza A-3
Separazione per distillazione
Distillazione semplice e con colonna
Questa esperienza ha lo scopo di illustrare allo studente i primi rudimenti dei metodi di purificazione delle sostanze organiche liquide e di come sia necessario una procedura di controllo della purezza stessa. Inoltre, lo studente può verificare un fenomeno fisico come la costanza della temperatura di distillazione per un composto puro e rendersi conto che uno stretto controllo della temperatura di distillazione può portare ad una separazione più efficace dei componenti della miscela. Inoltre nota che l’uso delle colonne migliora la separazione, apprende le basi della teoria dei piatti e viene informato dell’esistenza degli azeotropi. Apprende, inoltre, l’uso di vetreria da montare con giunti smerigliati e ha i primi contatti con vetreria più complessa, come le colonne Vigreux, i giunti di distillazione, i refrigerati e i termometri con giunto smerigliato e con le operazioni di recupero dei distillati. In questa prova si usa etanolo denaturato colorato in rosa, come da disposizioni legislative, per cui lo studente può rendersi conto che il colorante non viene distillato.
Lo studente eseguirà le seguenti prove.
Distillazione di etanolo denaturato mediante un semplice raccordo di Claisen munito di termometro e refrigerante liscio. Durante la distillazione lo studente eseguirà un controllo periodico della temperatura che riporterà in grafico in funzione del volume di distillato e in funzione del tempo. Successivamente lo studente eseguirà la distillazione di una miscela 1:1 di etanolo denaturato e acqua usando una colonna Vigreux di separazione, controllerà la temperatura come in precedenza, riportando in grafico i risultati in funzione della quantità di distillato e del tempo.
Distillazione semplice
Obiettivo:
Separare l’alcool etilico dal colorante in una soluzione di alcool etilico denaturato mediante distillazione semplice.
Prerequisiti:
Concetto di tensione di vapore.
Principi su cui si basa la distillazione.
Questa tecnica si adopera per separare miscugli omogenei i cui componenti hanno temperature di ebollizione differenti fra loro.
Materiali e attrezzature:
Strumenti di misura |
Cilindro graduato da 100 mL (s = 1mL) |
Vetreria |
Pallone da 250 mL (A) Testa di distillazione (B) Termometro (C) Tubo di Liebig (refrigerante) (D) Raccordo angolare (E) Becker 100 mL di raccolta |
Materiale di consumo |
50 mL di miscela di acqua e alcool denaturato |
Varie |
Pinze e sostegni Ebollitori in porcellana Piastra riscaldante |
Procedimento:
Il montaggio del distillatore è stato effettuato secondo lo schema di figura, applicando il grasso di silicone sui raccordi smerigliati, per garantire una migliore tenuta.
Nel pallone vengono introdotti 50 mL di miscela di acqua e alcool denaturato nel rapporto 1:2 e gli ebollitori per controllare l’ebollizione.
Si apre l’acqua di refrigerazione quindi si accende il mantello riscaldante e si porta il liquido all’ebollizione che deve essere regolare per tutta la durata della distillazione. Inizialmente la temperatura salirà velocemente, per poi stabilizzarsi e rimanere costante intorno alla temperatura di ebollizione del solvente. Si raccoglie quindi in un unico pallone la frazione che passa a temperatura costante.
Osservazioni
L’alcool etilico denaturato di partenza è di colore rosa. Il distillato risulta invece incolore e man mano che avviene la distillazione, si intensifica la colorazione nel pallone di distillazione.
Distillazione frazionata
Obiettivo:
Separare i componenti di una soluzione aventi temperature di ebollizione non molto differenti mediante distillazione frazionata. Nel nostro caso acqua (T.eb: 100 °C) ed etanolo (T.eb: 78 °C).
Questa tecnica si adopera per separare miscugli omogenei i cui componenti hanno temperature di ebollizione non molto differenti fra loro.
Prerequisiti:
Concetto di tensione di vapore.
Concetto di piatto teorico di distillazione.
Concetto di azeotropo
Tempo occorrente: 1/2 lezione
Materiali e attrezzature:
Strumenti di misura: |
Cilindro graduato da 50 mL (s = 1mL) |
Vetreria: |
Pallone da 100 mL (A) Testa di distillazione (B) Termometro (C) Tubo di Liebig (refrigerante) (D) Raccordo angolare (E) Colonna di frazionamento (F) Becker 100 mL di raccolta |
Materiale di consumo: |
50 mL di miscela di acqua e alcool denaturato |
Varie: |
Pinze e sostegni Ebollitori in porcellana Piastra riscaldante |
Procedimento:
Il montaggio del distillatore è stato effettuato secondo lo schema di figura, applicando il grasso di silicone sui raccordi smerigliati, per garantire una migliore tenuta. Nel pallone sono stati introdotti 50 mL di miscela di alcool denaturato e acqua con gli ebollitori per controllare l’ebollizione. Si apre l’acqua di refrigerazione, quindi si accende il mantello riscaldante e si porta il liquido all’ebollizione che deve essere regolare per tutta la durata della distillazione. Quando i vapori, dopo ripetuti cicli di evaporazione e condensazione, arrivano al refrigerante, la temperatura si stabilizza e rimane costante intorno alla temperatura di ebollizione del solvente più volatile, fino a sua completa separazione. A questo punto la temperatura dapprima si abbassa, quindi si alza fino a stabilizzarsi su quella di ebollizione del secondo solvente. Si raccolgono separatamente le due frazioni ottenute alle due temperature di ebollizione, scartando la frazione condensata prima del primo solvente e le prime gocce condensate del secondo solvente.
Valutazione del rischio
Rischio chimico
Reattivo: Etanolo
Pericolosità: Infiammabile. Rischio moderato
Altri tipi di rischio
Apparecchi elettrici. Vetreria di laboratorio.
Rischio moderato. Pericolo di scottature. Maneggiare con precauzione.
Esperienze del Gruppo B
Esposizione delle esperienze Gruppo B
Esperienza B-1
Estrazione con solvente
Esperienza B-2
Potere rotatorio degli zuccheri
Esperienza B-3
Estrazione della caffeina
Esperienza B-1
Estrazione con solvente
Con questa esperienza lo studente effettua l’estrazione di una sostanza semplice mediante l’uso di un solvente. In tal modo apprende i primi concetti di distribuzione di una sostanza tra solventi differenti. Come estensione dell’esperienza può effettuare la determinazione spettrofotometrica della sostanza estratta.
Lo studente eseguirà le seguenti prove.
Estrazione dello iodio da una soluzione idroalcoolica mediante cicloesano. Determinazione spettrofotometrica dello iodio in cicloesano.
Estrazione dello iodio da una soluzione idroalcoolica mediante cicloesano
Obiettivo:
Estrarre lo iodio da una soluzione idroalcoolica mediante cicloesano.
Prerequisiti:
L’estrazione con solventi si basa sulla diversa affinità che ha un soluto rispetto a due solventi diversi. Il solvente estraente deve essere scelto in modo che non sia miscibile né reagisca col primo e che abbia una maggiore affinità verso il soluto rispetto al primo solvente.
Materiali e attrezzature:
Strumenti di misura |
Cilindro graduato da 50 mL (s = 1mL) |
Vetreria |
Bacchette di vetro (2) Becher di vetro da 100 mL (2) Beuta 100 mL (2) Imbuto separatore da 250 mL |
Materiale di consumo |
Soluzione idroalcoolica di iodio (50 mL) Cicloesano 50 mL |
Varie |
Sostegno con portaimbuto |
Procedimento:
Si versa la soluzione idroalcoolica di iodio nell’imbuto separatore. Questa soluzione è di colore giallo bruno.
Si aggiungono 15 mL di cicloesano (incolore). Si tappa l’imbuto e lo si agita per permettere l’intimo contatto fra i due solventi. Di tanto in tanto si capovolge l’imbuto e si apre il rubinetto per far sfiatare. Effettuare l’operazione sotto cappa.
Si lasciano decantare le soluzioni appoggiando l’imbuto separatore all’apposito sostegno. La fase acquosa è in basso mentre quella organica è in alto. Si stappa l’imbuto e si fa defluire la fase acquosa in un becher. Si raccoglie la fase organica in una beuta versandola dal collo dell’imbuto.
Si versa nuovamente la fase acquosa nell’imbuto e si ripetono altre due volte i passaggi precedenti.
Osservazioni
La soluzione idroalcoolica iniziale si presenta di colore giallo bruno, il cicloesano puro è incolore.
Alla prima estrazione si nota già che la soluzione acquosa risulta molto più chiara, mentre la fase organica assume una colorazione fucsia, indice del passaggio dello iodio in questa fase.
Le successive estrazioni portano alla decolorazione della fase acquosa.
Con la stessa quantità di solvente, 2 separazioni successive hanno dato una maggiore resa di separazione rispetto ad una sola separazione globale. Per separare un soluto da una soluzione mediante estrazione con solvente, una volta scelto il solvente estraente e la quantità da utilizzare, porta a maggiori rese effettuare più estrazioni con piccole quantità di solvente piuttosto che una sola estrazione con tutto il solvente preventivato.
Determinazione spettrofotometrica dello iodio in cicloesano
Materiali e attrezzature:
Strumenti di misura |
Spettrofotometro UV-Vis |
Vetreria |
Becher di vetro 100 mL (2) Beute da 50 mL (2) Pipette Pasteur con tettarella Cuvetta di plastica Imbuto di vetro |
Materiale di consumo |
Carta da filtro Cicloesano Solfato di sodio anidro |
Varie |
Sostegno con portaimbuto Spatola |
Procedimento:
Versare 30 mL circa di soluzione iodica nella beuta, aggiungere un paio di spatolate di solfato di sodio anidro e attendere che venga assorbita l’umidità. Filtrare la soluzione con un filtro a pieghe in una beuta pulita e asciutta.
Procedimento per ottenere gli spettri:
Lanciare il programma SCAN. Entrare in SETUP e cliccare sulla linguetta CARY. Selezionare le seguenti condizioni:
Scan control: Advanced Dl: 450-600
Average time : 0.5 Mode: Abs
Data interval: 0.5 Y max: 0.6
Scan rate: 60 Beam mode: dual beam
Cliccare sulla linguetta BASELINE e selezionare: Baseline Correction
Tornare alla finestra del grafico, effettuare prima la lettura della linea di base con il bianco e, successivamente, lo spettro con la soluzione di iodio. Determinare la lunghezza d’onda di massimo assorbimento. Dovrebbe essere intorno a 520 nm.
Valutazione del rischio
Rischio chimico
Reattivo: Cicloesano
Pericolosità: infiammabile. Alta volatilità. Rischio superiore al moderato.
Operare sotto cappa. Maneggiare con i guanti.
Reattivo: Iodio
Pericolosità: Irritante. Rischio moderato.
Maneggiare con i guanti
Altri tipi di rischio
Apparecchi elettrici. Vetreria di laboratorio.
Rischio moderato. Pericolo di scottature. Maneggiare con precauzione.
Esperienza B-2
Potere rotatorio degli zuccheri
Con questa esperienza lo studente si confronta con determinazione sia di tipo soggettivo, il potere dolcificante, che di tipo oggettivo, le determinazione della rotazione della luce polarizzata e con determinazioni di tipo pratico ma rapido, saccarimetro di Brix, a fronte di altre più lente ma più accurate.
Lo studente eseguirà le seguenti prove.
Determinazione soggettiva del potere dolcificante di saccarosio, glucosio e fruttosio. Determinazione del potere rotatorio di saccarosio, glucosio e fruttosio. Determinazione di concentrazioni zuccherine
Determinazione soggettiva del potere dolcificante di saccarosio, glucosio e fruttosio
Obiettivo:
Determinare soggettivamente il potere dolcificante degli zuccheri.
Prerequisiti:
Concetto di concentrazione percentuale.
Materiali e attrezzature:
Strumenti di misura |
Bilancia analitica Cilindro graduato da 50 mL (s = 1mL) |
Vetreria |
Becker da 50 mL (3) Bacchetta di vetro Vetrini d’orologio o scodellini da pesata(3) |
Materiale di consumo |
Saccarosio (1 g) Glucosio (1 g) Fruttosio (1 g) Acqua potabile |
Varie |
Spatola |
Procedimento:
Si pesa un grammo di ciascun zucchero e lo si scioglie in 50 mL di acqua potabile. Si assaggia un piccolo sorso di ciascuna soluzione sciacquandosi la bocca con acqua tra una prova e l’altra. Si cerca di valutare e porre in ordine crescente il potere dolcificante dei tre zuccheri.
Determinazione del potere rotatorio di saccarosio, glucosio e fruttosio
Obiettivo:
Determinare il potere rotatorio specifico degli zuccheri.
Prerequisiti:
Concetto di potere rotatorio.
Materiali e attrezzature:
Strumenti di misura |
Bilancia analitica Matracci tarati da 50 mL (2) Polarimetro |
Vetreria |
Becker da 100 mL (3) Bacchetta di vetro Vetrini d’orologio o scodellini da pesata (3) Imbuto |
Materiale di consumo |
Saccarosio (15 g) Glucosio (15 g) Fruttosio (15 g) Acqua distillata |
Varie |
Spatola |
Procedimento:
Preparare due soluzioni acquose a concentrazione crescente dei diversi zuccheri.
Le soluzioni si ottengono sciogliendo: 5.0 e 10.0 grammi di zucchero in matracci da 50 mL. In tal modo si ottengono soluzione zuccherine con le seguenti concentrazioni:
0.100 e 0.200 g/mL di zucchero.
Riempire il tubo del polarimetro con acqua distillata, azzerare (minimo di luce). Effettuare le letture con le soluzioni zuccherine. Usare la lettura a concentrazione zero per correggere gli altri valori
![]() Sulla base della relazione dove
Sulla base della relazione dove
![]() è l’angolo di rotazione della soluzione in esame
è l’angolo di rotazione della soluzione in esame
![]() è la lunghezza del tubo in decimetri;
è la lunghezza del tubo in decimetri;
![]() è la concentrazione dello zucchero in g/mL
è la concentrazione dello zucchero in g/mL
![]() è l’angolo di rotazione specifica (linea D del sodio 589.3 nm)
è l’angolo di rotazione specifica (linea D del sodio 589.3 nm)
calcolare il valore medio di ![]()
Potere rotatorio specifico di alcuni zuccheri
Saccarosio C12H22O11 +66.5°
Glucosio C6H12O6 +52.5°
Fruttosio C6H12O6 -89.5°
Determinazione di concentrazioni zuccherine
Obiettivo:
Determinare le concentrazioni di alcune soluzioni zuccherine.
Prerequisiti:
Concetto di concentrazione.
Materiali e attrezzature:
Strumenti di misura |
Bilancia Polarimetro Saccarimetro di Brix |
Vetreria |
Beuta da 50 mL (3) Bacchetta di vetro Vetrini d’orologio o scodellini da pesata (3) Imbuto |
Materiale di consumo |
Soluzione di saccarosio Frutta fresca Succo di frutta Acqua distillata |
Varie |
Spatola Pipetta Pasteur con tettarella |
Procedimento:
Ogni studente avrà a disposizione una soluzione di saccarosio con concentrazione incognita. Usando il polarimetro e basandosi sul valore di rotazione specifica da lui determinata e applicando la relazione e ![]() dovrà determinare la concentrazione del saccarosio.
dovrà determinare la concentrazione del saccarosio.
Inoltre effettuerà la stessa lettura con il saccarimetro di Brix. Con lo stesso saccarimetro misurerà le concentrazioni zuccherine del succo di frutta fresca e in bottiglia.
Grado Brix = g di saccarosio per 100 g di soluzione
Valutazione del rischio
Rischio chimico
Nullo
Altri tipi di rischio
Apparecchi elettrici. Vetreria di laboratorio.
Rischio moderato. Pericolo di scottature. Maneggiare con precauzione.
Esperienza B-3
Estrazione della caffeina
Con questa esperienza lo studente effettua l’estrazione di una sostanza naturale mediante l’uso di solventi, la caratterizza per via spettrofotometrica e ne effettua il riconoscimento mediante il confronto con lo spettro di un campione autentico.
Struttura della caffeina (una purina) |
|
Lo studente eseguirà le seguenti prove.
Estrazione della caffeina dal the, sia normale che “deteinato”, mediante infusione a caldo in ambiente acido, liberazione della caffeina dal suo sale per basificazione ed estrazione con cloroformio. Tracciamento dello spettro della caffeina mediante spettrofotometro UV-Vis usando cuvette di quarzo e determinazione della lunghezza d’onda di massimo assorbimento. Confronto con lo spettro della caffeina commerciale e confronto fra le assorbanze della caffeina estratta dai due tipi di the.
Estrazione della caffeina dal the
Obiettivo:
Estrarre caffeina da due tipi di the e determinarne le quantità relative.
Prerequisiti:
Conoscenza dei metodi di estrazione con solventi e delle tecniche di distillazione
Materiali e attrezzature:
Strumenti di misura |
Cilindo graduato da 25 mL Cilindro graduato da 100 mL (s = 1mL) |
Vetreria |
Bacchette di vetro (3) Becher di plastica da 500 mL (2) Becher di vetro da 250 mL Becher di vetro da 100 mL Beuta 100 mL Imbuto diam. 6 cm(2) Imbuto separatore 250 mL Matracci tarati da 50 mL (2) Pipette Pasteur con tettarella (4) |
Materiale di consumo |
The normale in bustine The “deteinato” in bustine Acqua acidulata con HCl NaOH 20% Cloroformio Na2SO4 anidro Cartina indicatrice Ghiaccio |
Varie |
Aste di sostegno con pinze e anelli sostegni Ebollitori in porcellana Carta da filtro Forbici Spatole Piastra scaldante elettrica |
Procedimento:
Si prepara il tè ponendo 1 bustina in 150 mL di acqua acidulata calda. Quando è freddo (usare un bagno di ghiaccio) si alcalinizza con NaOH 20% (verificare con la cartina indicatrice), si lascia ancora raffreddare con bagno di ghiaccio. Quando la soluzione è fredda si versa in un imbuto separatore da 250 mL. Sotto cappa, si effettuano due estrazioni successive con 20 mL di cloroformio ciascuna. La separazione con solvente deve essere fatta agitando non troppo vigorosamente per cercare di evitare le emulsioni. Se durante le operazioni di estrazione con cloroformio (aggiunta, mescolamento, sfiatamento, ecc..) si forma una schiuma (emulsione), si può aggiungere un po’ di NaCl alla fase acquosa per ridurre l'inconveniente.
La parte organica (cloroformio) si raccoglie nella parte bassa dell’imbuto, da cui viene estratta. Le due porzioni di cloroformio si uniscono e si trattano con tanto Na2SO4 anidro da assorbire tutta l’acqua residua. Si filtra con filtro a pieghe in un matraccio da 50 mL e si porta a volume con cloroformio.
Determinazione spettrofotometrica:
Obiettivo:
Tracciare lo spettro della caffeina e confrontare le concentrazioni degli estratti
Prerequisiti:
Conoscenza dello spettrofotometro e del concetto di concentrazione
Materiali e attrezzature:
Strumenti di misura |
Pipetta tarata da 1mL (s = 0.01mL) Pipetta tarata da 5 mL (s = 0.1mL) Spettrofotometro UV-Vis |
Vetreria |
Becher di vetro da 100 mL Becher di plastica da 250 mL Cuvetta di quarzo Matracci tarati da 25 mL (4) Matracci tarati da 50 mL (2) Pipette Pasteur con tettarella (6) |
Materiale di consumo |
Cloroformio Soluzione di caffeina in cloroformio (0.020 g/L) |
Varie |
Carta asciugatutto |
Procedimento per ottenere gli spettri:
Lanciare il programma SCAN. Entrare in SETUP e cliccare sulla linguetta CARY. Selezionare le seguenti condizioni:
Scan control: Advanced Dl: 300-240
Average time : 0.5 Mode: Abs
Data interval: 0.5 Y max: 1.0
Scan rate: 60 Beam mode: dual beam
Cliccare sulla linguetta BASELINE e selezionare: Baseline Correction
Tornare alla finestra del grafico, effettuare prima la lettura della linea di base con il bianco e, successivamente, lo spettro con la soluzione di caffeina commerciale alla concentrazione di 0.020 g/L. Determinare la lunghezza d’onda di massimo assorbimento. Dovrebbe essere intorno a 276 nm.
Effettuare lo spettro con le soluzioni di caffeina estratte dai due tipi di te dopo aver diluito opportunamente le soluzioni in modo che l’assorbanza massima non sia superiore a 1. Confrontare gli spettri con quello campione e, basandosi sulle diluizioni effettuate, confrontare la differenza di contenuto di caffeina nei due tipi di the.
Valutazione del rischio
Rischio chimico
Reattivo: Cloroformio
Pericolità: Tossico. Solvente molto volatile. Infiammabilità bassa. Rischio superiore al moderato.
Operare sotto cappa. Maneggiare con i guanti.
Reattivo: NaOH 20%
Pericolosità: Corrosivo. Rischio moderato.
Maneggiare con i guanti. Indossare occhiali di protezione
Reattivo: Caffeina
Pericolosità: Eccitante. Rischio moderato.
Maneggiare con guanti
Reattivo: Acqua acidulata
Pericolosità: Irritante. Rischio minimo. Evitare l’ingestione.
Reattivo: Solfato di sodio anidro
Pericolosità: minima. Rischio minimo. Evitare l’ingestione.
Altri tipi di rischio
Apparecchi elettrici. Vetreria di laboratorio.
Rischio moderato. Pericolo di scottature. Maneggiare con precauzione.
Esperienza C-1
Estrazione con solvente di oli essenziali
Distillazione in corrente di vapore. Estrazione degli oli essenziali dalle acque
Questa esperienza ha lo scopo di illustrare allo studente un’applicazione pratica dei metodi di purificazione delle sostanze organiche liquide. Questa esperienza colpisce favorevolmente lo studente in quanto di ottengono sostanze dotate di odori piacevoli e di largo uso, e li pone di fronte ad un uso commerciale valido e universalmente accettato della chimica. Inoltre, farà pratica sulla distillazione in corrente di vapore, rendendosi conto dell’additività delle tensioni di vapore di liquidi immiscibili, rispetto alla mutua interazione delle stesse nei liquidi miscibili. Apprenderà, infine, i principi dell’estrazione di una sostanza dall’acqua mediante l’uso di solventi immiscibili con l’acqua stessa.
Lo studente eseguirà le seguenti prove.
Estrazione degli oli essenziali da materiali vegetali mediante ebollizione in ambiente acquoso (distillazione in corrente di vapore). Estrazione, mediante un solvente clorurato, degli oli essenziali dispersi in acqua, distillazione e recupero del solvente e ottenimento degli oli essenziali come residuo.
Distillazione in corrente di vapore
Obiettivo:
Estrarre l’olio essenziale da materiali vegetali.
Prerequisiti:
Tensione di vapore;
Quando due liquidi non miscibili vengono riscaldati, si ha ebollizione quando la somma delle loro tensioni di vapore raggiunge la pressione esterna. Questo fa sì che si formi vapore ad una temperatura inferiore a quella di ebollizione di ciascuna delle sostanze. Questa tecnica è utile quando una sostanza tende a decomporsi prima di raggiungere l’ebollizione.
Suggerimenti:
Si può operare l’estrazione partendo da: buccia di arancia, buccia di limone, semi di anice stellato, stecche di cannella. Per quanto riguarda le bucce di agrumi, si deve fare attenzione a prelevarne solo lo strato superficiale colorato, usando una grattugia per agrumi. Le altre sostanze devono essere polverizzate o ridotte in piccoli pezzi.
Materiali e attrezzature:
Strumenti di misura |
Bilancia tecnica (s = 0,001 g) |
Vetreria |
Beuta da 250 mL Imbuto di vetro Tappo (C) Pallone da 500 mL (A) Raccordo angolare (E) Raccordo di Claisen (B) Refrigerante di Liebig (D) |
Materiale di consumo |
Acqua distillata Anice stellato 10 g / Opp. Cannella 10 g Opp. Arance (2) / Opp. Limoni (2) |
Varie |
Ebollitori di ceramica Piastra riscaldante Sostegni e pinze per pallone e refrigerante |
Procedimento:
L’apparecchiatura usata per la distillazione in corrente di vapore è simile a quella precedentemente utilizzato per la distillazione, al posto del termometro è stato inserito un tappo. Da questa apertura si versa acqua per ripristinare il livello durante la distillazione della sostanza.
Si pongono nel pallone da distillazione 10 g di materiale naturale con alcuni ebollitori e con acqua fino a riempire il pallone per circa la metà del suo volume.
Si apre il rubinetto per l’acqua di raffreddamento e si comincia il riscaldamento in modo da permettere una ebollizione regolare. Il distillato, che si raccoglie in una beuta, ha un aspetto lattiginoso, indice della presenza dell’olio essenziale assieme all’acqua. Quando diminuisce il livello del liquido nel pallone da distillazione, si toglie il tappo e si ripristina il volume aggiungendo acqua con l’aiuto di un imbuto.
Si termina la distillazione quando il distillato non è più lattiginoso, normalmente si raccolgono circa 180-200 mL di distillato.
Estrazione degli oli essenziali dalle acque
Obiettivo:
Questa esperienza completa quella in cui si estraggono mediante distillazione in corrente di vapore gli oli essenziali da materiali vegetali.
Prerequisiti:
Estrazione con solventi
Materiali e attrezzature:
Strumenti di misura |
Cilindro graduato (V = 50 mL s = 1ml) |
Vetreria |
Bacchetta di vetro Becker da 250 mL Beute da 100 mL (2) Imbuto di vetro Imbuto separatore da 250 mL Pallone da 250 mL Raccordo di Claisen Refrigerante di Liebig Provetta |
Materiale di consumo |
180-200 mL acqua con oli essenziali (da esperienza distillazione in corrente di vapore) Diclorometano Solfato di sodio anidro |
Varie |
Carta da filtro Ebollitori in porcellana Forbici Piastra riscaldante Spatola Sostegno e anello per imbuto separatore |
Procedimento:
L’operazione di estrazione va effettuata sotto cappa indossando guanti protettivi ed occhiali antispruzzo poiché si tratta di solvente clorurato. Si pone l’acqua aromatica in un imbuto separatore insieme a 20 mL di diclorometano, si mescola per qualche secondo quindi si alza la parte bassa dell’imbuto e si sfiata; si ripete tale operazione più volte per favorire il contatto tra le fasi. Si appoggia l’imbuto al sostegno aprendo il tappo per facilitare la separazione fra le fasi quindi si raccoglie il diclorometano (che contiene l’olio essenziale) in una beuta pulita e asciutta. Essendo il solvente organico più pesante dell’acqua, esso si separerà dall’acqua rimanendo sotto. Si eseguono 2 estrazioni da 20 ml per un totale di 40 ml di solvente utilizzato.
Le frazioni organiche raccolte devono essere disidratate prima di proseguire con la distillazione aggiungendo al solvente un cucchiaio di solfato di sodio, mescolando e filtrando dopo qualche minuto per eliminare il solido. Il solvente contenente l’olio viene quindi distillato con un impianto per distillazione semplice. Il diclorometano distilla fra i 40 e i 50 °C, temperatura che può variare nell’intervallo in base alla quantità di olio disciolto. Anche questa operazione va eseguita sotto cappa e adottando le dovute misure di sicurezza personale. Si interrompe la distillazione quando rimangono nel pallone da distillazione 2-3 millilitri di liquido. Evitare assolutamente che il pallone vada a secco. Il liquido residuo viene posto in una provetta che rimarrà aperta e sotto cappa per favorire l’evaporazione delle ultime tracce di solvente.
Principali sostanze presenti nei vari oli essenziali:
Dai semi di anice

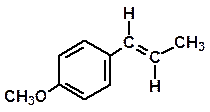
Anetolo Estragolo
(componente principale) (in modesta percentuale)
Da stecche di cannella Da bucce di arancia e limone
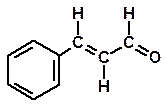
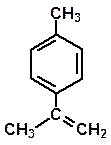
Cinnamaldeide Limonene
Valutazione del rischio
Rischio chimico
Reattivo: Diclorometano
Pericolità: Tossico. Solvente molto volatile. Infiammabilità bassa. Rischio superiore al moderato.
Operare sotto cappa.
Reattivo: Solfato di sodio anidro
Pericolosità: minima. Rischio minimo. Evitare l’ingestione.
Altri tipi di rischio
Apparecchi elettrici. Vetreria di laboratorio.
Rischio moderato. Pericolo di scottature. Maneggiare con precauzione.
Esperienza C-2
Cromatografia su strato sottile di pigmenti vegetali
Con questa esperienza lo studente apprende diversi metodi di estrazione delle sostanze organiche naturali dai vegetali e la loro separazione e caratterizzazione usando un metodo di separazione cromatografica.
Lo studente eseguirà le seguenti prove.
Estrazione dei pigmenti naturali da concentrato di pomodoro, buccia d’arancia o spinaci e loro separazione mediante cromatografia su strato sottile (TLC).
Obiettivo:
Separare i pigmenti presenti in alcuni vegetali mediante cromatografia su strato sottile
Prerequisiti:
Il principio della separazione cromatografica si basa sulla diversa affinità delle sostanze da separare nei confronti della fase stazionaria (in questo caso lo strato di silice depositato sulla lastrina) e della fase mobile (la miscela di solventi utilizzata). La fase mobile è detta anche eluente.
Calcolo degli Rf 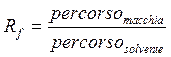
Materiali e attrezzature
Strumenti di misura |
Bilancia tecnica (s = 1 mg) Pipette graduate di varie misure con porcellini |
Vetreria |
Becker da 250 mL (4) Becker da 100 mL (4) Vetri da orologio in grado di coprire il becker (4) Capillari forati (3) |
Materiale di consumo |
3 g di concentrato di pomodoro 5 g di buccia di arancia grattugiata 5 g di spinaci ben strizzati e tritati Lastrine cromatografiche al gel di silice (supporto alluminio) 15 mL di miscela per pigmenti di arancia e pomodoro 15 mL di miscela per separare le clorofille degli spinaci n-esano 20 mL etanolo 10 mL Solfato di sodio anidro |
Varie |
Grattugia Forbici Mantello riscaldante Matita Righello |
Procedimento:
La miscela per separare i pigmenti di arancia e pomodoro e composta da n-esano e diclorometano. Quella per separare le clorofille degli spinaci e composta da cicloesano, acetone e dietil etere.
Si versa un piccolo strato di una miscela in un becher da 250 mL e un piccolo strato della seconda miscela in un altro becher da 250 mL. l becher si chiudono con i vetrini da orologio per saturare l'atmosfera dei vapori del solvente utilizzato. Questa operazione è necessaria per evitare l'evaporazione del solvente man mano che per capillarità sale lungo la lastrina.
I campioni si preparano in becker da 100 mL ponendo le quantità di campione con mezza spatolata di solfato di sodio come disidratante e facendo due estrazioni con complessivi 10 mL di n-Esano: l'estratto viene raccolto in un altro becker da 100 mL che verrà posto al di sopra di un mantello riscaldante acceso (sotto cappa!) per eliminare parte del solvente e concentrare così il pigmento. ATTENZIONE A NON FAR ANDARE A SECCO. Gli spinaci si estraggono meglio con etanolo, quindi si consiglia questo solvente per l'estrazione al posto del n-Esano.
Le lastrine cromatografiche si preparano dalle lastre commerciali ritagliando con precisione strisce di 3 cm di larghezza e di altezza tale da non superare il bordo del becher. Per la preparazione si usano forbici matita e righello.
Si segna con una matita la linea di base a circa 1.5 cm dal bordo facendo attenzione a segnarlo dalla parte tagliata più precisa per evitare sviluppi anomali.
La semina delle lastre avviene mediante un capillare che si immerge brevemente in uno degli estratti preparati precedentemente e che, poi, si poggia sulla linea di base per depositare il campione sotto forma di una macchia puntiforme. Successivamente si pone la lastra nel becker a sviluppare, facendo attenzione che il solvente non tocchi direttamente il pigmento seminato. Durante la sua lenta ascesa lungo la fase stazionaria (gel di silice) l’eluente porta con sé i vari pigmenti che si depositano a varie altezze in base alla loro diversa affinità nei confronti della fase mobile e della fase stazionaria.
Si termina lo sviluppo quando il fronte del solvente arriva a circa 1 cm dal bordo superiore: a questo punto si segna il fronte del solvente e si lascia asciugare la lastra. Una volta asciugata si può procedere al calcolo dei rapporti frontati (Rf) per caratterizzare ciascuna sostanza dei pigmenti depositati. Rf = Db / Df dove Db = distanza della macchia dalla linea di base; Df = distanza del fronte del solvente dalla linea di base.
Valutazione del rischio
Rischio chimico
Reattivo: Diclorometano
Pericolità: Tossico. Solvente molto volatile. Infiammabilità bassa. Rischio superiore al moderato.
Operare sotto cappa.
Reattivi: Cicloesano, n-esano
Pericolosità: infiammabili. Alta volatilità. Rischio superiore al moderato. Operare sotto cappa. Maneggiare con i guanti.
Reattivi: Etanolo, Acetone
Pericolosità: infiammabili. Volatili. Rischio moderato
Reattivo: Dietil Etere
Pericolosità: tossico. Infiammabile. Alta volatilità. Rischio superiore al moderato. Operare sotto cappa. Maneggiare con i guanti.
Reattivo: Solfato di sodio anidro
Pericolosità: minima. Rischio minimo. Evitare l’ingestione.
Altri tipi di rischio
Apparecchi elettrici. Vetreria di laboratorio.
Rischio moderato. Pericolo di scottature. Maneggiare con precauzione.
Esperienza C-3
Riconoscimento di fenoli e aniline, tintura di fibre tessili
Con questa esperienza lo studente ha il primo approccio con una tecnica di riconoscimento basata su reazioni di chimica organica che danno composti colorati. Il metodo permette di riconoscere sia fenoli che ammine aromatiche con reazioni cromatiche chiare e di semplice esecuzione. Lo studente apprende che, per effettuare certe reazioni, occorre, talvolta, applicare tecniche adatte. In questo caso occorre operare con bagno di ghiaccio e aggiungere i reattivi in una precisa sequenza. Lo studente effettuerà delle reazioni di diazotazione in ambiente acido di ammine aromatiche con acido nitroso generato “in situ” ottenendo i sali di diazonio. Con questo reagente effettuerà delle reazioni di copulazione con fenoli, operando prima su carta, per una prova rapida di riconoscimento. Dal fatto che la reazione su carta dia una macchia intensamente colorata o no lo studente riconoscerà quali sostanze sono fenoli e quali ammine. A questo punto potrà effettuare le reazioni tra sali di diazonio e fenoli in provetta per avere un’idea della quantità di prodotto ottenibile. Inoltre gli studenti effettueranno una prova di tintura della lana usando un colorante commerciale: il Rosso Congo.
ATTENZIONE
In questa esperienza si formano e si maneggiano coloranti, che, per loro natura colorano, specialmente i capi di vestiario. Quindi indossare il camice ed evitare di indossare capi di abbigliamento pregiati e/o costosi.
Lo studente eseguirà le seguenti prove.
Riconoscimento di ammine aromatiche e fenoli
Obiettivo:
Riconoscere ammine aromatiche primarie e fenoli.
Prerequisiti:
Conoscenza del gruppo funzionale amminico e fenolico
Materiali e attrezzature:
Vetreria |
Bacchette di vetro 8 Pipette Pasteur con tettarella 4 Vetrini d’orologio o scodellini portacampioni 4 Provette da 15 cm 12 Beuta da 50 mL 2 Cilindro graduato da 10 mL Becher da 250 mL di vetro Becher da 250 mL di plastica |
Materiale di consumo |
Sostanza incognita A Sostanza incognita B Sostanza incognita C Sostanza incognita D Soluzione 1% di 2-Naftolo in NaOH 5% (Provetta 1) Soluzione 1% di 3-Cloroanilina (m-Cloroanilina) in HCl 5% (Prov. 2) Soluzione 1% di Nitrito di sodio Soluzione di NaOH 5% Soluzione di HCl 5% Ghiaccio Carta da filtro |
Varie |
Forbici Spatole Piastra riscaldante. |
Procedimento:
Versare acqua nel becher di vetro e metterla a scaldare sulla piastra. Mettere ghiaccio nel becher di plastica e immergervi la provetta 2.
Dividere le sostanze incognite in due porzioni uguali e versare una porzione di ciascuna sostanza nelle provette AX, BX, CX e DX, rispettivamente. Versare 5 mL circa di NaOH 5% in ciascuna delle provette AX, BX, CX e DX (usare il cilindro graduato). Aiutandosi con la bacchetta di vetro e l’acqua calda provare a sciogliere le sostanze incognite. Alla fine raffreddare le provette sotto un getto d’acqua del rubinetto e metterle da parte.
Con una pipetta Pasteur, versare a gocce la soluzione di nitrito di sodio nella provetta 2, contenente la 3-cloroanilina agitando con una bacchetta di vetro. La soluzione di 3-cloroanilina deve essere ben raffreddata e mantenuta in ghiaccio per tutta la reazione. Versare solo due pipettate di nitrito di sodio. Lasciare riposare in ghiaccio per due o tre minuti in modo che si sviluppi il sale di diazonio derivante dalla 3-cloroanilina:
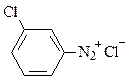
Questo processo si chiama: diazotazione.
Immergere una bacchetta di vetro pulita nella provetta 1, contenente il 2-naftolo, e depositare una macchia della grandezza di un centesimo di Euro su un pezzetto di carta da filtro. Immergere una bacchetta di vetro pulita nella soluzione di sale di diazonio e toccare la macchia precedente. Dovrebbe apparire una vistosa colorazione rossa o viola. Se non appare si è sbagliato qualcosa e bisogna ricominciare.
La comparsa della colorazione ci dimostra che nella provetta 1 c’è un fenolo e in quella due c’era una anilina primaria (adesso c’è il sale di diazonio corrispondente). Una volta accertata la presenza del sale di diazonio, si può procedere all’analisi delle sostanze incognite A, B, C, D.
Prendere un pezzo di carta da filtro di 15 x 10 cm. Usando una bacchetta di vetro intinta nella provetta AX depositare 1 macchia dalle dimensioni di un centesimo di Euro, sciacquare la bacchetta e ripetere il procedimento con la provetta BX depositando la macchia a 2 cm dalla precedente. Ripetere lo stesso procedimento con le provette CX e DX. Denominare le macchie nel modo seguente:
A |
B |
C |
D |
O |
O |
O |
O |
Con una bacchetta di vetro intinta nel sale di diazonio toccare le quattro macchie. Quelle che si colorano di rosso o di viola sono fenoli, le altre sono ammine.
Fatto questo accertamento, si sciolgono con 5 mL di HCl (usare il cilindro) le porzioni di ammine non utilizzate, si raffreddano con ghiaccio e si procede alla loro diazotazione come descritto in precedenza.
Le porzioni di fenoli non utilizzate si sciolgono con 5 mL di NaOH (usare il cilindro) e si raffreddano sotto il rubinetto come descritto in precedenza.
Con le soluzioni di fenoli si formano varie macchie su carta da filtro e si toccano con i diversi sali di diazonio ottenuti dalle ammine per notare le diverse colorazioni e, infine, con una pipetta Pasteur, si versino a gocce le ammine diazotate nelle soluzioni fenoliche e si osservi la formazione dei coloranti azoici.
Tintura della lana con un colorante commerciale
Obiettivo:
Dimostrare che si forma un legame tra fibra e colorante.
Prerequisiti:
Conoscenza del gruppo funzionale azo
Materiali e attrezzature:
Vetreria |
Bacchetta di vetro Becher di vetro da 250 mL Beuta da 100 mL |
Materiale di consumo |
100 mL di soluzione contenente 0,1% di Rosso Congo e 0,2 di carbonato di sodio Filato di lana bianca Carta asciugatutto |
Varie |
Piastra scaldante Fon |
Procedimento:
Lavare la lana con un po’ di detersivo, sciacquare bene. Scaldare all’ebollizione la soluzione di colorante e immergervi la lana. Agitare con la bacchetta di vetro e mantenere l’ebollizione per 15 minuti. Spegnere il fornello, estrarre la lana con l’aiuto della bacchetta, sciacquarla sotto l’acqua corrente e asciugarla, prima con la carta asciugatutto e poi con il fon.
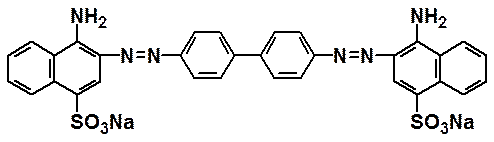
Colorante Rosso Congo
Valutazione del rischio
Rischio chimico
Reattivi: 3-Cloroanilina, 2-Nitroanilina
Pericolosità: tossici anche per contatto. Rischio superiore al moderato
Maneggiare con i guanti.
Reattivi: 2-Naftolo, acido 1-idrossi-2-naftoico, acido 2-idrossi-1-naftoico
Pericolosità: irritanti. Rischio moderato. Maneggiare con i guanti.
Reattivi: Acido cloridrico, Idrossido di sodio, Carbonato di sodio.
Pericolosità: Corrosivi. Rischio moderato. Maneggiare con i guanti.
Reattivo: Colorante Rosso Congo.
Pericolosità: Tossico. Rischio moderato. Maneggiare con i guanti.
Altri tipi di rischio
Apparecchi elettrici. Vetreria di laboratorio.
Rischio moderato. Pericolo di scottature. Maneggiare con precauzione.
Fonte: http://unica2.unica.it/galberti/biotin/didattica/mater_didatt/Sommario_Prove_Stud.doc
Sito web da visitare: http://unica2.unica.it
Autore del testo: Università degli studi di Cagliari Facoltà di Scienze M.F.N.
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve