I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Si definisce energia di ionizzazione il lavoro necessario per allontanare un elettrone da un atomo. L’atomo a cui è stato tolto un elettrone diviene uno ione positivo. L’energia di prima ionizzazione è riferita all’allontanamento del primo elettrone, l’energia di seconda ionizzazione all’elettrone successivo etc. L’energia di ionizzazione dipende:
Nel periodo i fattori che influenzano maggiormente l’energia di ionizzazione sono il raggio atomico e la carica nucleare, da sinistra verso destra il raggio atomico diminuisce e la carica nucleare aumenta, quindi l’energia di prima ionizzazione cresce al passare dal primo all’ottavo gruppo della tavola periodica. Come abbiamo già detto gli elementi del primo gruppo hanno energia di seconda ionizzazione elevata, quindi quest’ultima cresce al passare dal secondo all’ottavo gruppo della tavola periodica. L’energia di terza ionizzazione cresce al passare dal terzo all’ottavo gruppo. Per quanto riguarda le ionizzazioni successive per la loro elevata energia non si verificano nella formazione dei legami. Infatti, gli elementi che dovrebbero cedere quattro o più elettroni non formano mai legami ionici. Nel gruppo l’energia di ionizzazione dipende principalmente dal raggio atomico e dall’effetto schermo. Dall’alto verso il basso cresce sia il raggio atomico sia l’effetto schermo quindi l’energia di ionizzazione diminuisce.
L’affinità elettronica è l’energia che viene liberata quando un atomo acquista elettroni, con conseguente formazione di ioni negativi. Per questa proprietà periodica le considerazioni sono simili a quelle fatte per l’energia di ionizzazione. I gas nobili a differenza di quanto accade per l’energia di ionizzazione, avendo una struttura elettronica stabile, non hanno affinità elettronica, quindi essa cresce al passare dal primo al settimo gruppo e diminuisce dall’alto verso il basso. Tra i fattori che la influenzano, quello più importante è la stabilità elettronica. Gli elementi del sesto e del settimo gruppo hanno elevata affinità elettronica, ciò accade perché essi hanno la possibilità di raggiungere una struttura elettronica stabile, acquistando rispettivamente uno o due elettroni.
L’elettronegatività è la tendenza che hanno gli atomi ad attrarre su di sé gli elettroni impegnati nei legami. Dipende dagli stessi fattori che influenzano l’energia di ionizzazione e l’affinità elettronica, cresce dal primo al settimo gruppo e diminuisce dall’alto verso il basso nella tavola periodica. Si può calcolare con la seguente relazione: E = (PI + AE) / 2.
Quando due o più atomi si legano per dare origine ad un composto chimico, gli elettroni impegnati nei legami, subiscono l’attrazione da parte dei nuclei (elettronegatività).
Quando gli atomi che formano il legame hanno uguale elettronegatività, la forza di attrazione esercitata dai nuclei sugli elettroni è uguale in modulo, quindi gli elettroni sono equamente condivisi ed il legame che si viene a formare si chiama covalente.
Quando gli atomi che formano il legame hanno elettronegatività diversa, la forza di attrazione sarà diversa. Per equilibrare le due forze gli elettroni dovranno spostarsi verso l’atomo più elettronegativo. A seguito dello spostamento l’atomo meno elettronegativo risulterà carico positivamente e l’atomo più elettronegativo risulterà carico. Come abbiamo già detto gli elettroni si sposteranno fin quando le due forze non diventeranno uguali. L’entità dello spostamento dipenderà dalla differenza di elettronegatività esistente tra gli atomi che formano il legame. Se la differenza di elettronegatività è piccola anche lo spostamento lo sarà, quindi la carica presente sugli atomi sarà parziale ed il legame si chiamerà covalente polare. Se la differenza di elettronegatività è elevata, per arrivare ad un equilibrio delle forze di attrazione, gli elettroni si dovranno spostare quasi completamente sull’atomo più elettronegativo, la carica sarà intera ed il legame sarà ionico. In genere il legame si considera covalente quando la differenza di elettronegatività è inferiore a 1,67, si considera ionico se la differenza di elettronegatività è superiore.
Carattere del Legame |
||||||||||
Differenza di elettronegatività |
0,00 |
0,65 |
0,94 |
1,19 |
1,43 |
1,67 |
1,91 |
2,19 |
2,54 |
3,03 |
% carattere ionico |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
% carattere covalente |
100 |
90 |
80 |
70 |
60 |
50 |
40 |
30 |
20 |
10 |
Il legame ionico è la forza elettrostatica che tiene uniti ioni di segno contrario. Si forma tra atomi con elevata differenza di elettronegatività, cioè quando elementi del primo o del secondo gruppo A si legano con elementi del sesto o del settimo gruppo A. Ad esempio tra sodio e cloro si ha:
Da notare che sia il sodio sia il cloro assumono una configurazione elettronica stabile.
Nei composti ionici, gli ioni sono disposti nello spazio con regolarità cioè formano un reticolo cristallino. Ad esempio il cloruro di sodio cristallizza con reticolo cubico a facce centrate. All’interno del reticolo ogni ione Na+ è circondato da 6 ioni Cl- e ogni ione Cl- da 6 ioni Na+. I composti ionici hanno in genere elevate temperature di fusione ed allo stato solido non sono lavorabili e non conducono la corrente elettrica. Sono solubili in acqua e nei solventi polari. Allo stato fuso ed in soluzione acquosa conducono la corrente elettrica.
Il legame covalente avviene per messa a comune di elettroni spaiati tra atomi con elettronegatività uguale o poco diversa (inferiore a 1,67). La forza che tiene uniti gli atomi nel legame covalente è data dall’attrazione che i nuclei, degli atomi che prendono parte al legame, esercitano nei confronti degli elettroni condivisi.
Il legame covalente può essere:
Esempi di legame covalente puro:
il cloro possiede un elettrone spaiato, mettendolo a comune raggiunge l’ottetto.
![]()
l’azoto possiede tre elettroni spaiati mettendoli a comune, forma un triplo legame covalente e raggiunge una struttura elettronica stabile (ottetto).
![]()
Esempi di legame covalente polare:
![]() Nel legame tra idrogeno e cloro, essendo il cloro più elettronegativo, gli elettroni impegnati nel legame sono più vicini al nucleo del cloro. L’allontanamento degli elettroni dall’atomo dell’idrogeno lascia parzialmente scoperto il nucleo, quindi sull’atomo di idrogeno avremo una parziale carica positiva. Sull’atomo del cloro avremo un eccesso di elettroni, quindi una parziale carica negativa. La presenza di queste cariche rende uguali le forze di attrazione che i due nuclei esercitano sugli elettroni di legame e rafforza il legame grazie alla forza di attrazione che si instaura tra i due atomi.
Nel legame tra idrogeno e cloro, essendo il cloro più elettronegativo, gli elettroni impegnati nel legame sono più vicini al nucleo del cloro. L’allontanamento degli elettroni dall’atomo dell’idrogeno lascia parzialmente scoperto il nucleo, quindi sull’atomo di idrogeno avremo una parziale carica positiva. Sull’atomo del cloro avremo un eccesso di elettroni, quindi una parziale carica negativa. La presenza di queste cariche rende uguali le forze di attrazione che i due nuclei esercitano sugli elettroni di legame e rafforza il legame grazie alla forza di attrazione che si instaura tra i due atomi.
La presenza di questa forza di attrazione elettrostatica, che abbiamo riscontrato nel legame ionico, fa si che il legame covalente polare venga classificato in parte ionico e in parte covalente. Per mettere in evidenza la presenza dei residui di carica la molecola si rappresenta: (Hd+- Cld-).
![]() Le molecole che presentano una separazione di carica, come l’acido cloridrico, sono polari. Una molecola polare prende il nome di dipolo. Nelle molecole biatomiche la presenza del legame covalente polare fa sì che la molecola risulti sempre polare. Nelle molecole pluriatomiche, per stabilire se sono polari occorre prendere in considerazione la distribuzione dei residui di carica. Se i residui di carica sono disposti in modo simmetrico, come nel caso dell’anidride carbonica, la molecola sarà apolare.
Le molecole che presentano una separazione di carica, come l’acido cloridrico, sono polari. Una molecola polare prende il nome di dipolo. Nelle molecole biatomiche la presenza del legame covalente polare fa sì che la molecola risulti sempre polare. Nelle molecole pluriatomiche, per stabilire se sono polari occorre prendere in considerazione la distribuzione dei residui di carica. Se i residui di carica sono disposti in modo simmetrico, come nel caso dell’anidride carbonica, la molecola sarà apolare.
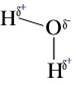 Se i residui non sono disposti in modo simmetrico, cioè tagliando con un piano la molecola è possibile dividerla in due parti con residui di carica diversi, come nel caso dell’acqua, la molecola sarà polare.
Se i residui non sono disposti in modo simmetrico, cioè tagliando con un piano la molecola è possibile dividerla in due parti con residui di carica diversi, come nel caso dell’acqua, la molecola sarà polare.
La forza di un dipolo può essere definita dal suo momento dipolare m. Il momento dipolare dipende dal residuo di carica (Q) e dalla distanza tra i due nuclei (d). m = Q d. Più elevato è il momento dipolare, più intense sono le forze intermolecolari, e di conseguenza i punti di fusione e di ebollizione delle sostanze sono più alti.
Il legame covalente si può considerare formato per sovrapposizione di orbitali. Si possono verificare i seguenti casi:
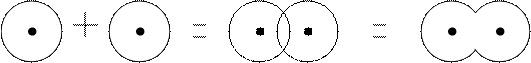
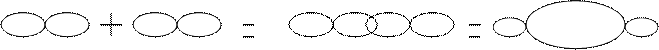
Il legame dativo è un particolare legame covalente dove un atomo mette a comune un doppietto elettronico ( donatore ), e un altro atomo mette a comune un orbitale vuoto ( accettore ). Questo tipo di legame, in genere, si indica con una freccia che va dal donatore all’accettore.
I composti covalenti hanno un intervallo di punti di fusione piuttosto grande. Ciò è dovuto ai legami presenti tra le molecole di questi composti (Forze di Van der Waals).
Le forze di Van der Waals possono essere di tre tipi:
Il legame a idrogeno è un particolare legame molecolare, si forma tra molecole in cui l’atomo di idrogeno è legato covalentemente ad atomi con elevata elettronegatività e di piccole dimensioni (O, N, F). La forza di questo legame è dovuta alle piccole dimensioni dell’atomo di idrogeno e quindi all’elevata densità di carica positiva presente su di sé. Ad es. nell’acido fluoridrico si ha:
La forza dei legami molecolari varia al variare della polarità delle molecole. Il più forte, tra detti legami è il legame a idrogeno; i legami dipolo – dipolo, dipolo – dipolo indotto e le forze di dispersione sono, nell’ordine in cui li abbiamo citati, sempre più deboli. Dalla forza di questi legami dipendono le proprietà fisiche delle sostanze. Per passare dallo stato liquido allo stato aeriforme in una sostanza si devono spezzare i legami molecolari esistenti, quindi maggiore è la forza del legame molecolare e maggiore sarà la temperatura di ebollizione. Ad es. l’acqua, pur avendo un peso molecolare più piccolo dell’acido solfidrico (H2S), ha le temperature di fusione e di ebollizione nettamente più alte. Le sostanze, come l’acqua, in cui vi è legame a idrogeno in genere hanno tutte elevate temperature di fusione e di ebollizione.
Il legame metallico è un particolare tipo di legame chimico che tiene uniti gli atomi dei metalli. Sulla natura di questo legame esistono numerose teorie. I metalli hanno struttura cristallina; la teoria più semplice considera il reticolo cristallino dei metalli formato da un insieme di ioni positivi, tutti uguali (i cationi del metallo), disposti ordinatamente nello spazio tridimensionale e immersi in un <<mare>> di elettroni. Il legame metallico è dovuto alla forza di coesione che si instaura tra gli ioni positivi e gli elettroni.
Questi ultimi, potendo scorrere in modo relativamente libero all’interno del reticolo cristallino, sono responsabili della capacità dei metalli di condurre la corrente elettrica. Dalla facilità con cui si possono muovere gli elettroni nei metalli è facile dedurre come essi siano in grado di acquistare, per poi cedere sotto forma di luce, piccolissime quantità di energia. E’ possibile mettere in evidenza quanto abbiamo detto osservando come luccica la superficie di un metallo appena tagliato.
La mobilità degli elettroni serve a spiegare anche la lavorabilità (duttilità e malleabilità), altra proprietà dei metalli, che ha consentito all’uomo la loro utilizzazione già nell’antichità. E’ possibile ottenere fili e lamine metalliche molto sottili grazie alla possibilità di scorrimento dei piani del reticolo. I piani del reticolo possono scivolare perché gli elettroni li accompagnano nel loro movimento e continuano a garantire la forza di coesione che tiene uniti gli ioni positivi.
Come è noto i metalli differiscono notevolmente, tra di loro, sia per la conducibilità che per la lavorabilità. Le strutture cristalline più comuni dei metalli sono:
1) Struttura cubica a corpo centrato, in cui ogni atomo del metallo è circondato da altri otto atomi. Il reticolo cristallino si può considerare formato dall’unione di tante celle elementari. In questo caso la cella elementare si può identificare con un cubo in cui gli atomi occupano il centro e gli spigoli, per un totale di nove atomi.
2) Struttura cubica a facce centrate, in cui ogni atomo è circondato da altri dodici atomi. La cella elementare è costituita da un cubo in cui gli atomi occupano gli spigoli e il centro di ogni faccia, per un totale di quattordici atomi.
3) Struttura esagonale compatta, in cui ogni atomo è circondato da altri dodici atomi. La cella elementare è costituita da un prisma a base esagonale tagliato da un piano triangolare; gli atomi occupano i vertici del prisma, il centro delle due basi e gli spigoli del triangolo, per un totale di diciassette atomi.
La lavorabilità dipende dal tipo di reticolo, cioè dalla densità atomica. I metalli più facilmente lavorabili sono quelli che cristallizzano con reticolo cubico a facce centrate (maggiore densità atomica), i meno lavorabili sono quelli che hanno reticolo cubico a corpo centrato (minore densità atomica); è intermedia la lavorabilità degli altri metalli. Per spiegare le proprietà dei metalli, soprattutto la conducibilità, occorre prendere in considerazione la teoria degli orbitali molecolari, vista la sua complessità prenderemo in considerazione soltanto alcuni concetti necessari a raggiungere il nostro scopo.
Secondo la teoria degli orbitali molecolari ,dalla sovrapposizione di due orbitali atomici si ottengono due orbitali molecolari, uno di energia più bassa e l’altro di energia più elevata rispetto agli orbitali atomici di partenza. Nei metalli la sovrapposizione riguarda tutti gli atomi presenti nel cristallo e quindi un elevatissimo numero di orbitali. A differenza degli orbitali atomici che hanno tutti la stessa energia, quelli molecolari hanno energia diversa. La differenza di energia tra un orbitale molecolare e l’altro dipende dal numero di orbitali impegnati nel legame, nel caso dei metalli tale differenza, visto il numero di orbitali, è piccolissima. Rappresentando graficamente gli orbitali molecolari, nel caso dei metalli, vista la piccolissima differenza di energia tra un orbitale e l’altro, non possiamo indicarli con delle righe ma con un settore, ad esempio un rettangolo che prende il nome di banda.
Dalla sovrapposizione degli orbitali che contengono gli elettroni più esterni (orbitali di valenza) si ha la banda di valenza. Gli elettroni per potersi muovere devono avere a disposizione orbitali vuoti su cui possano passare con un piccolissimo dispendio di energia. Quando la banda di valenza è parzialmente occupata tali orbitali sono a disposizione nella stessa banda di valenza, che funge quindi anche da banda di conduzione. Quando la banda di valenza è piena, gli orbitali vuoti sono sulla banda successiva, cioè su quella che deriva dalla sovrapposizione degli orbitali atomici successivi a quelli di valenza. Nei metalli quando la banda di valenza è piena, quella di conduzione è adiacente , quindi gli elettroni si possono muovere facilmente.
Nei semiconduttori tra la banda di valenza e quella di conduzione esiste un piccolo salto energetico, che gli elettroni sono in grado di superare quando viene applicata una sufficiente differenza di potenziale.
Negli isolanti tra la banda di valenza e quella di conduzione il salto energetico è elevato, gli elettroni non riescono, quindi, a passare nella banda di conduzione.
Quando gli atomi si avvicinano per dar luogo ad un legame chimico, le nuvole elettroniche venendo a contatto si respingono. Per rendere minima la repulsione, ciascun atomo, dispone i suoi orbitali il più lontano possibile. Rispetto agli orbitali dell’atomo isolato, gli orbitali ibridi hanno forma ed orientamento diverso. Il cambiamento di forma e di orientamento della nuvola elettronica prende il nome di ibridazione. La forma degli orbitali ibridi è quella indicata in figura.
Per mescolamento di un orbitale s con un orbitale p si formano due nuovi orbitali ibridi sp uguali, disposti a 180°. La molecola che si formerà sarà lineare.
Per mescolamento di un orbitale s con due orbitali p si formano tre nuovi orbitali ibridi sp² uguali, disposti a 120°. La molecola che si formerà sarà planare.
Per mescolamento di un orbitale s con tre orbitali p si formano quattro nuovi orbitali ibridi sp3 uguali, disposti a 109,5°. La molecola che si formerà sarà tetraedrica.
Per stabilire l’ibridazione degli atomi di una molecola, e quindi l’angolo di legame, basta contare i legami chimici (il triplo e il doppio legame equivalgono ad uno semplice) e i doppietti elettronici non impegnati nel legame.
In alcuni casi oltre all’ibridazione si ha la promozione di elettroni .
Il berillio ha sull’ultimo livello energetico due elettroni presenti sull’orbitale 2s, nel cloruro di berillio esso forma con il cloro due legami covalenti. La formazione dei due legami è spiegabile considerando che il berillio, avendo a disposizione gli orbitali 2p vuoti, promuove un elettrone dall’orbitale 2s all’orbitale 2p e mescolando detti orbitali, forma due nuovi orbitali ibridi sp con un elettrone spaiato ciascuno. Gli orbitali ibridi sp, per rendere minima l’energia di repulsione, si dispongono, linearmente, con un angolo di legame di 180°.
Il boro ha sull’ultimo livello energetico due elettroni presenti sull’orbitale 2s e un elettrone sull’orbitale 2p, nel cloruro di boro esso forma con il cloro tre legami covalenti. La formazione dei tre legami è spiegabile considerando che il boro, avendo a disposizione due orbitali 2p vuoti, promuove un elettrone dall’orbitale 2s all’orbitale 2p e mescolando l’orbitale s con i due orbitali 2p, forma tre nuovi orbitali ibridi sp² con un elettrone spaiato ciascuno.Gli orbitali ibridi sp², per rendere minima l’energia di repulsione, si dispongono, nel piano, con un angolo di legame di 120°.
Il carbonio ha sull’ultimo livello energetico due elettroni presenti sull’orbitale 2s e due sugli orbitali 2p; nel tetracloruro di carbonio esso forma con il cloro quattro legami covalenti. La formazione dei quattro legami è spiegabile considerando che il carbonio, avendo a disposizione un orbitale 2p vuoto, promuove un elettrone dall’orbitale 2s all’orbitale 2p e mescolando detti orbitali, forma quattro nuovi orbitali ibridi sp3 con un elettrone spaiato ciascuno.
Gli orbitali ibridi sp3, per rendere minima l’energia di repulsione, si dispongono, nello spazio lungo i vertici di un tetraedro, con un angolo di legame di 109,5°.
Fonte: http://ipssctamoro.gov.it/ilgabbiano/applications/core/interface/file/attachment.php?id=22
Sito web da visitare: http://ipssctamoro.gov.it/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve