I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
RICHIAMI TEORICI
![]() ppmm = parti per milione =
ppmm = parti per milione =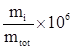
Analogamente:
ppbm = parti per miliardo (bilione) = 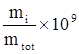 = 103 x ppmm
= 103 x ppmm
![]() % (W/W) =
% (W/W) = 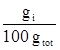
(1 m3 =1000 L; 1 g = 1000 mg)
% (W/V) = 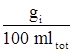
Conversione: unità di misura W/W ßà W/V conoscendo la densità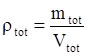
ppmV = parti per milione =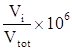
NOTA: Utilizzando questa unità di misura per miscele di gas, la concentrazione non varia al variare della pressione.
Per convertire la concentrazione di un gas da ppmV a unità di misura di massa (e viceversa) si utilizza la Legge dei gas perfetti:
PV = nRT
Dove:
P= pressione
V = volume occupato
n = numero di moli
T = temperatura espressa in °K : T(°C )= T(°K) - 273.15
R = costante universale dei gas 8.205 x 10-5 (m3·atm)/(mole·°K)
Dalla legge dei gas perfetti segue che la concentrazione in ppmv per miscele di gas può essere calcolata nei seguenti modi:
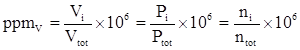
Dove ![]() è la frazione molare e Pi la pressione parziale
è la frazione molare e Pi la pressione parziale
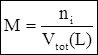 dove:
dove: 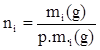
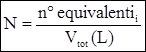 dove:
dove: 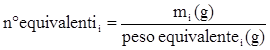
per reazioni acido-base: il peso equivalente è uguale al peso molecolare diviso per il numero di moli H+ che una mole di acido può donare oppure il numero di moli con cui una base può reagire
per reazioni re-dox: il peso equivalente è uguale al peso molecolare diviso per il numero di moli di elettroni scambiati.
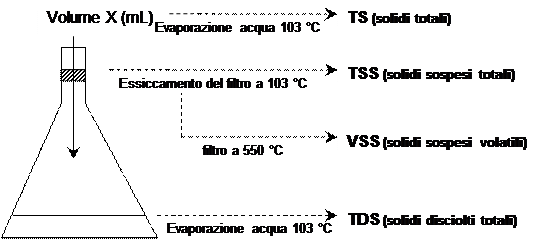
CONCENTRAZIONE DI PERTICELLE in ARIA e ACQUA
TSP (Total Suspended Particulate) si esegue facendo passare un volume noto di aria attraverso un filtro e apprezzando la variazione del peso del filtro prima e dopo il passaggio.
PM2.5 = TSP dopo aver eliminato particelle di dimensioni più grandi di 2.5 μm
La determinazione dei solidi sospesi in acqua si fa nello stesso modo filtrando un volume noto di acqua su un filtro 0.45 μm (si assume questa la dimensione che distingue il sospeso dal disciolto).
ESERCIZIO 1.1
In 1 Kg di suolo è stata misurata la concentrazione di un solvente chimico, il tricloroetilene (TCE). L’analisi ha stabilito un contenuto di 5 mg di TCE. Qual è la concentrazione in ppm e in ppb?
soluzione
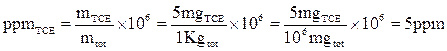
OSSERVAZIONE: passaggio alla stessa unità di misura al numeratore e al denominatore.
![]()
Esercizio 1.2
Una miscela di gas contiene 0.001 moli di biossido di zolfo (SO2) e 0.999 moli di aria.
Qual è la concentrazione di SO2 espressa in ppmV?
Soluzione
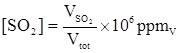
Il volume occupato dalla mistura di gas e quello occupato dal solo SO2 si ricavano dalla legge dei gas perfetti:
PV = nRT
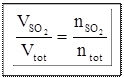
![]()
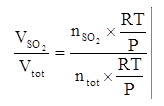
![]()
![]()
![]()
OSSERVAZIONE: In condizioni di temperatura e pressione costanti la frazione di volume è uguale alla frazione molare.
Quindi la frazione molare può essere utilizzata al posto della frazione di volume per il calcolo della concentrazione in ppmV :
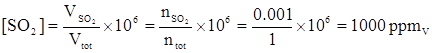
ESERCIZIO 1.3
La concentrazione di SO2 misurata in aria è pari a 100 ppbV. Qual è la concentrazione in μg/m3? Si assuma che la temperatura sia 28 °C e la pressione 1 atm.
Soluzione
Se la concentrazione è 100 ppbv significa che ogni m3 di miscela gassosa contiene 10-7m3 di SO2. Questo è chiaro ponendo Vtot = 1 m3 nella definizione di ppmv:
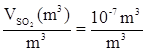
![]()
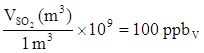
Dalla Legge dei gas perfetti si determinano le moli di SO2 contenuti in 1 m3 di miscela gassosa:
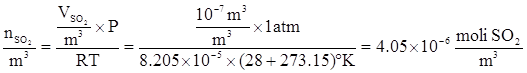
OSSERVAZIONE 1: notare il passaggio da °C a °K
OSSERVAZIONE 2: Occorre scegliere l’espressione giusta per R (attenzione alle unità di misura).In questo caso: 8.205 x 10-5 (m3·atm)/(mole·°K).
Conoscendo il peso molecolare di SO2 (64 g/mole), si calcola la concentrazione in μg/m3 di SO2 nella miscela gassosa:

ESERCIZIO 1.4
La concentrazione misurata di policloruri bifenili (PCB) nell’aria è 450 pg/m3. Qual è la pressione parziale di PCB? Il peso molecolare del PCB è 325 g/mole e si assuma che la pressione atmosferica sia 1 atm e la temperatura 0°C.
Soluzione
Si calcola la frazione molare ![]() in modo da calcolare Pi mediante la relazione:
in modo da calcolare Pi mediante la relazione: 
Calcoliamo il numero di moli di PCB in 1 m3 di aria, conoscendo il peso molare del PCB:
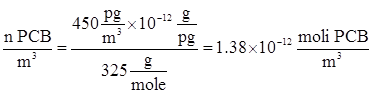
Calcoliamo poi il numero di moli di aria in un 1 m3 di aria mediante la legge dei gas perfetti:
![]()
Si può conoscere adesso la frazione molare:
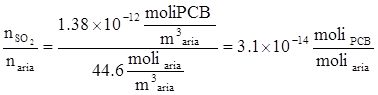
Poiché:
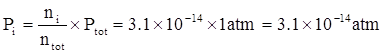
![]()

ESERCIZIO 1.5
Un campione d’acqua contiene 10 mg NO3-/L. Esprimere la concentrazione in ppmm ppbm, moli/L e in mg N_ NO3-/L.
Soluzione
La concentrazione in ppmm è definita nel modo seguente:
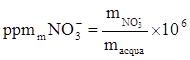
Conosciamo la massa di NO3- contenuti in 1 L di acqua (o meglio 1 L di soluzione), quindi ci resta da determinare la massa corrispondente a 1 L di soluzione.
Nel caso di soluzioni diluite, come quella dell’esercizio, si può approssimare la massa della soluzione con la massa dell’acqua pura, che ha densità:
![]()
quindi:
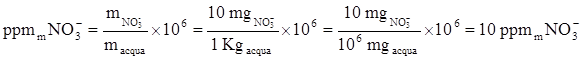
OSSERVAZIONE: Per soluzioni acquose diluite la concentrazione in mg/L è uguale alla concentrazione in ppm.
Per determinare la concentrazione in ppb (parti per miliardo) basta moltiplicare la concentrazione in ppm per 103:
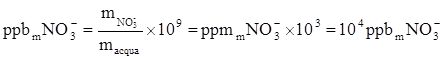
La concentrazione molare di NO3- esprime il numero di moli di NO3- contenute in 1 litro di
soluzione: 
Sapendo che ogni litro di soluzione contiene 10 mg NO3-, bisogna calcolare il numero di moli di NO3- corrispondenti (una mole di NO3- pesa 62g).

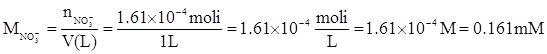
La concentrazione in mg N_NO3-/L esprime la concentrazione di NO3- come concentrazione di uno degli elementi che ne compongono la molecola (N).
Generalmente questo tipo di espressione della concentrazione si utilizza per quando si ha a che fare con una serie di composti che hanno in comune un elemento.
Ad esempio N è comunemente presente in acque naturali come ammoniaca (NH3), ione ammonio (NH4+), nitrito (NO2-) e nitrato (NO3-). Spesso è utile fare bilanci di massa di un elemento considerando la sua presenza in varie forme. Per questo è importante saper esprimere la concentrazione di un composto come concentrazione di uno dei suoi elementi.
Per esprimere la concentrazione in questo modo si deve ragionare in termini di moli e pesi molecolari.
Una mole di NO3- pesa 62 g e contiene una mole di N che pesa 14 g.
Si determinano allora le moli di NO3- contenute in 1 L come fatto in precedenza:
![]()
Il numero di moli di NO3- è uguale al numero di moli di N.
La massa di N corrispondente si calcola moltiplicando il numero di moli per il peso molecolare di N (14 g/mole):
![]()
Questa è la massa contenuta in 1 L, quindi la concentrazione di NO3- in mg N_NO3-/L è 2.25.
In modo più conciso per passare dalla concentrazione in NO3- alla concentrazione in N_NO3-/L basta moltiplicare per il rapporto fra i pesi molecolari:
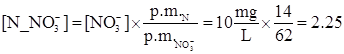
ESERCIZIO 1.6
L’effluente di un impianto di trattamento di acque reflue contiene ammonio a concentrazione di 9 mgN/L e nitriti a 0.5 mgN/L. Convertire le concentrazioni in mg NH4+/L e in mg NO2-/L.
Soluzione
Si utilizza lo stesso procedimento dell’esercizio precedente
Peso molecolare di N: 14 g/mole
Peso molecolare di NH4+:18 g/mole
Peso molecolare di NO2-: 46 g/mole
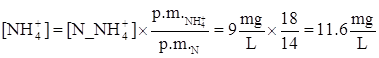
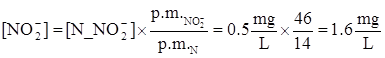
ESERCIZIO 1.7
Qual è il peso equivalente di HCl, H2SO4, NaOH, CaCO3 e CO2 disciolta?
Soluzione
Il peso equivalente si determina dividendo il peso molecolare per il numero di equivalenti.
Per stabilire il numero di equivalenti bisogna fare considerazioni circa la natura dei composti e il tipo di reazione a cui partecipano.
HCl à H+ + Cl-
Quindi ad HCl corrisponde 1 equivalente/mole, per cui il peso equivalente è:
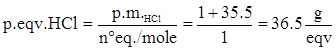
H2SO4à 2H+ + SO4-
Quindi a H2SO4 corrispondono 2 equivalenti/mole, per cui il peso equivalente è:
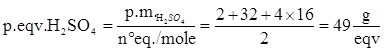
NaOH + H+à Na + H2O
Quindi a NaOH corrisponde 1 equivalente/mole, per cui il peso equivalente è:
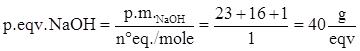
CaCO3 + 2H+à Ca2+ + CO32- + 2H+à Ca2+ + H2CO3
Quindi a CaCO3 corrispondono 2 equivalenti/mole, per cui il peso equivalente è:
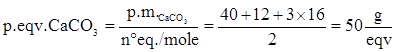
Per quanto riguarda CO2 disciolto il discorso è più complicato.
Quando CO2 è disciolto reagisce con l’acqua idratandosi dando luogo a acido carbonico:
CO2 + H2Oà H2CO3
L’acido carbonico è capace di fornire 2 equivalenti/mole, per cui il peso equivalente è:
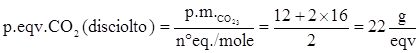
ESERCIZIO 1.8
Qual è la normalità di soluzioni 1M di HCl e H2SO4.
Soluzione
Si calcola la concentrazione della soluzione di HCl in g/L:
![]()
Dall’esercizio precedente il peso equivalente dell’HCl è 36.5 g/eqv, per cui la concentrazione normale della soluzione è:
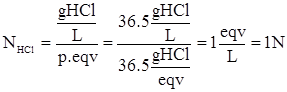
OSSERVAZIONE: Per soluzioni di HCl le concentrazioni molari e normali coincidono.
Si calcola la concentrazione della soluzione di H2SO4 in g/L:
![]()
Dall’esercizio precedente il peso equivalente dell’H2SO4 è 49 g/eqv, per cui la concentrazione normale della soluzione è:
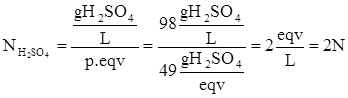
Per soluzioni di H2SO4 la concentrazione normale è il doppio della concentrazione molare.
ESERCIZIO 1.9
Vengono campionati 100000 L aria per la determinazione del particolato. Vengono misurati 12 mg di particelle con dimensione > 2.5 μm e 6 mg di particelle con dimensione < di 2.5 μm. Quali sono le concentrazioni di TSP e di PM2.5?
Soluzione
Per definizione il PM2.5 è il particolato composto da particelle con dimensioni inferiori a 2.5 μm.
![]()
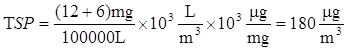
OSSERVAZIONE: si tratta di concentrazioni piuttosto alte, verosimilmente di aree fortemente urbanizzate. Per aria pulita il parametro TSP è 10 -20 μg/L.
ESERCIZIO 1.10
Viene analizzato un campione di acqua di scarico di 50 mL. I solidi totali sono (TS) sono 200 mg/L, i solidi sospesi totali (TSS) sono 160 mg/L, i solidi sospesi nonvolatili (FSS) sono 40 mg/L e i solidi sospesi volatili (VSS) sono120 mg/L.
Soluzione
(1)
TDS = TS – TSS In riferimento allo schema proposto si tratta del solido dell’acqua filtrata.
![]()

I solidi che restano sul filtro sono i solidi sospesi non volatili (FSS) che sono presenti in concentrazione di 40 mg/L. Il campione analizzato è di 50 ml, quindi:
Peso (FSS) = 40 mg/L x 50 mL x 10-3 L/mL= 2 mg
(3)
La concentrazione dei solidi totali (TS) è 200 mg/L e di questi 120 mg/L sono solidi sospesi volatili. I solidi volatili sono costituiti principalmente da sostanza organica, quindi:
120/200 x 100 = 60% di sostanza organica
OSSERVAZIONE: Questo è un limite inferiore perché a questi si vanno ad aggiungere i solidi disciolti volatili, ma questo dato non ce lo abbiamo!!
ESERCIZIO 1.10
In un impianto di potabilizzazione la disinfezione viene effettuata con cloro mediante dosaggio di ipoclorito di sodio (NaClO). In particolare viene utilizzata una soluzione commerciale di NaClO con titolo 18% in Cl2 (peso/volume).
Il dosaggio desiderato è 1 mg/L Cl2. La portata trattata è pari a 500 L/s.
Calcolare il volume del serbatoio necessario allo stoccaggio del prodotto commerciale sapendo che il rifornimento su gomma viene previsto 1 volta/mese.
Titolo 18% in Cl2 peso/volume significa che 100 ml di soluzione commerciale contengono 18 g di Cl2, ovvero 180 g/L, ovvero 180.000 mg/L
Per determinare il consumo del prodotto devo calcolare la portata di soluzione commerciale necessaria a ottenere il dosaggio desiderato nella portata trattata dall’impianto.
Il dosaggio desiderato è 1 mg/L. Ovvero per ogni litro di acqua trattata devo aggiungere 1 mg di Cl2.
Il problema si risolve quindi determinando il volume di soluzione commerciale che contiene 1 mg di Cl2.
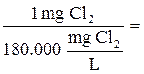 5.55 x 10-6 L di soluzione commerciale di NaClO
5.55 x 10-6 L di soluzione commerciale di NaClO
La portata che devo trattare è pari a 500 L/s, quindi la portata di soluzione commerciale di NaCl che devo dosare sarà:
(5.55 x 10-6 L) x (500 L/s) x (3600 s/h) = 10 L/h di soluzione commerciale di NaClO
Il rifornimento del prodotto avviene una volta al mese.
10 L/h x 24 h/gg x 30 gg/mese = 7200 L = 7.2 m3
Lo stoccaggio del prodotto può essere fatto in un serbatoio cilindrico di raggio 1 m e altezza 2.5 m (Volume: 7.85 m3).
Fonte: http://people.dicea.unifi.it/claudio/Lezioni/ES_Le%20concentrazioni.doc
Sito web da visitare: http://people.dicea.unifi.it
Autore del testo: Claudio Lubello
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve