I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Per costruire correttamente la maggior parte dei composti chimici è sufficiente conoscere alcune semplici regole. Fondamentale è a questo proposito il concetto di numero di ossidazione di un elemento (nox) o stato di ossidazione (stox).
Si definisce numero di ossidazione la carica, reale o formale, che acquista un atomo quando si assegnano convenzionalmente gli elettroni di legame all'atomo più elettronegativo.
La carica è reale nei composti ionici ed in tal caso coincide con il numero di cariche portate dallo ione.
Ad esempio nel cloruro di sodio NaCl, costituito da uno ione sodio Na+ e da uno ione cloro Cl-, il sodio presenta nox +1, mentre il cloro presenta nox -1.
La carica è formale nei composti covalenti. Ad esempio nell'acqua H2O, gli elettroni di legame vengono assegnati all'ossigeno più elettronegativo, il quale assume perciò convenzionalmente 2 cariche negative e presenta nox -2. Ciascuno dei due idrogeni presenta quindi nox +1.
Ciascun elemento chimico può presentare più di un numero di ossidazione. Vengono date di seguito alcune regole convenzionali per l'attribuzione dei numeri di ossidazione.
1) il nox delle sostanze elementari (H2, O2, Na, Cu etc) è sempre zero poiché ci troviamo di fronte ad atomi di uno stesso elemento, aventi perciò la stessa elettronegatività.
Più in generale quando in una molecola due atomi di uno stesso elemento si uniscono con legame covalente, gli elettroni di legame non vanno attribuiti a nessuno dei due atomi.
2) Il nox di uno ione è pari alla sua carica
Ca2+ (nox +2) Al3+ (nox +3) S2- (nox -2)
3) L'idrogeno presenta sempre nox +1 tranne che negli idruri, composti in cui si lega direttamente con i metalli alcalini e alcalino-terrosi che risultano essere gli unici elementi più elettropositivi dell'idrogeno. In tali composti l'idrogeno ha dunque nox -1.
Gli idruri si scrivono sempre facendo seguire al simbolo del metallo il simbolo dell'idrogeno.
idruro di sodio NaH, idruro di calcio CaH2 etc
4) L'ossigeno ha sempre nox -2 tranne che nei perossidi dove presenta nox -1. I perossidi sono composti dove l'ossigeno impegna uno dei suoi due elettroni per legarsi ad un altro atomo di ossigeno. secondo quanto previsto dalla regola numero 1 in questo caso gli elettroni del legame tra atomi uguali non vanno attribuiti, mentre viene attribuito all'ossigeno l'altro elettrone utilizzato per legarsi ad altri elementi
perossido di idrogeno o acqua ossigenata H2O2
H O O H
perossido di sodio Na2O2
Na O O Na
perossido di magnesio MgO2
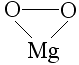
5) il fluoro, essendo l'elemento più elettronegativo della tabella periodica, ed avendo bisogno di un solo elettrone per raggiungere l'ottetto, ha sempre nox -1
6) Gli altri elementi del VII gruppo A hanno anch'essi nox -1, tranne quando si legano con elementi più elettronegativi, come ad esempio l'ossigeno, in tal caso presentano nox positivi.
7) In generale il nox più elevato di un elemento corrisponde al numero d'ordine del gruppo cui appartiene. Così gli elementi del primo gruppo presentano nox +1, quelli del secondo +2, quelli del terzo +3 e così via fino agli elementi del settimo gruppi che presentano come nox più elevato +7.
8) sempre in generale, quando un elemento presenta più di un nox, il valore di quest'ultimo diminuisce di 2 unità alla volta.
Così gli elementi del VII gruppo oltre al nox +7 possono presentare nox +5, +3, +1, -1.
gli elementi del VI gruppo oltre al nox + 6 possono presentare nox +4, +2, -2.
9) In una specie chimica neutra la somma dei nox di tutti gli atomi che la compongono deve sempre essere nulla.
10) In uno ione poliatomico la somma dei nox dei diversi atomi deve sempre essere pari alla carica totale dello ione.
Le ultime due regole ci permettono, partendo da una formula chimica, di calcolare il numero di ossidazione incognito della maggior parte degli elementi.
Ad esempio per calcolare il numero di ossidazione dello zolfo nell'anidride solforica SO2, procediamo come segue: ciascun atomo di ossigeno presenta nox -2; complessivamente i due atomi presentano nox -4; affinché la somma dei nox sia zero lo zolfo deve presentare nox + 4.
Calcoliamo il nox del carbonio nello ione poliatomico HCO3-: i tre atomi di ossigeno presentano complessivamente nox - 6, l'idrogeno presenta nox + 1. Sommando il nox degli ossigeni e dell'idrogeno si ottiene - 5. Affinché la somma di tutti i nox dia la carica complessiva dello ione -1, il carbonio deve presentare nox +4.
La conoscenza dei numeri di ossidazione ci permette di costruire in modo semplice i principali composti chimici.
I composti binari sono formati da due soli elementi chimici.
Convenzionalmente si scrivono ponendo per primo l'elemento meno elettronegativo, seguito dall'elemento più elettronegativo.
Il simbolo di ciascun elemento è seguito da un numero a pedice, detto indice, che indica quanti atomi di quell'elemento sono presenti nel composto.
Gli indici sono apposti in modo tale che, sommando i rispettivi nox, la molecola risulti neutra.
Per calcolare gli indici in modo semplice è sufficiente utilizzare il nox del primo elemento come indice del secondo e viceversa.
Ad esempio se vogliamo scrivere la formula di un composto binario formato da un elemento A il cui numero di ossidazione sia +2 e da un composto B il cui numero di ossidazione sia -3, otterremo
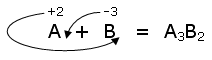
Si noti che l'elemento con il numero di ossidazione negativo (il più elettronegativo) è stato scritto per secondo.
Tale metodo di costruzione dei composti binari garantisce la neutralità della molecola.
Infatti nella molecola sono presenti 3 atomi di A per un totale di 6 cariche positive e 2 atomi di B per un totale di 6 cariche negative.
Qualora dopo aver calcolato gli indici questi risultino divisibili per uno stesso numero, gli indici vanno semplificati, tranne alcuni casi particolari (vedi ad esempio alcuni perossidi).
Ad esempio se vogliamo costruire un composto binario partendo dagli elementi X con numero di ossidazione +4 e Y con numero di ossidazione -2, si otterrà

Fanno eccezione alcuni composti, la cui formula è necessario conoscere, come ad esempio il perossido di idrogeno, H2O2, in cui gli indici non vanno semplificati.
Sono composti dell'idrogeno con metalli più elettropositivi. In tali composti l'idrogeno presenta nox -1 (ione idruro H-) e quindi nella formula va scritto per secondo.
Gli idruri dei metalli alcalini (I gruppo A) che presentano nox +1, hanno formula generale
MeH
Ad esempio idruro di potassio, KH
Gli idruri dei metalli alcalino terrosi (II gruppo A), che presentano tutti nox +2, hanno formula generale
MeH2
Ad esempio idruro di calcio, CaH2.
Il loro nome è formato dal termine "idruro" seguito dal nome del metallo
Sono composti in cui è presente il gruppo perossido ( O O ) unito ad elementi più elettropositivi. Nei perossidi ciascun atomo di ossigeno presenta nox -1.
Il loro nome è formato dalla parola "perossido" seguito dal nome dell'elemento legato.
Ad esempio
Perossido di idrogeno H2O2, perossido di bario BaO2.
Sono composti in cui un metallo si lega con l'ossigeno (nox -2).
Si formano per la reazione di un metallo con l'ossigeno
Metallo + O2 ® ossido
La reazione è rapida con i metalli dei primi gruppi, che presentano forte carattere metallico, più lenta con gli altri metalli.
Il loro nome è formato dalla parola "ossido" seguito dal nome del metallo.
I gruppo A |
Li2O, Na2O, K2O etc
II gruppo A |
BeO, MgO, CaO etc
III gruppo A |
il boro è un semimetallo Al2O3, Ga2O3 etc
IV gruppo A |
Gli unici metalli sono stagno e piombo che presentano nox +2 e +4, formando con l'ossigeno due tipi di ossidi. In tal caso il composto a nox maggiore prende la desinenza -ico, quello a nox minore prende la desinenza -oso.
Stagno (+2, +4) ossido stannoso SnO ossido stannico SnO2
Piombo (+2, +4) ossido piomboso PbO ossido piombico PbO2.
Il minio (antiruggine) Pb3O4, viene considerato un ossido salino o piombato piomboso (Pb2+)2PbO44-
Principali ossidi dei gruppi B
I gruppo B |
Rame (nox +1, +2) ossido rameoso Cu2O, ossido rameico CuO
Argento (+1) ossido d'argento Ag2O
Oro (+1,+3) ossido auroso Au2O, ossido aurico Au2O3
II gruppo B |
Zinco (+2) ossido di zinco ZnO
Cadmio (+2) ossido di cadmio CdO
VI gruppo B |
Mercurio (+1, +2) ossido mercuroso Hg2O ossido mercurico HgO
Il Cromo (+2, +3, +6) si comporta come un metallo con i numeri di ossidazione +2 e +3,
Cromo (+2, +3) ossido cromoso CrO ossido cromico Cr2O3
VII gruppo B |
Il Manganese (+2, +3, +4, +6, +7) si comporta come un metallo con i nox più bassi, mentre con il nox +4 forma il biossido di manganese MnO2 che presenta carattere anfotero
Manganese (+2, +3) ossido manganoso MnO ossido manganico Mn2O3
VIII gruppo B |
.
Ferro (+2, +3) ossido ferroso FeO ossido ferrico Fe2O3
Cobalto (+2, +3) ossido cobaltoso CoO ossido cobaltico Co2O3
Nichel (+2, +3) ossido nicheloso NiO ossido nichelico Ni2O3.
ANIDRIDI
Le anidridi sono composti binari dei non metalli con l'ossigeno.
Il loro nome è formato dalla parola "anidride" seguita dal nome del non metallo.
Non Metallo + O2 Anidride
VII gruppo A |
Cloro (+1, +3, +5, +7) anidride ipoclorosa (nox +1) Cl2O
anidride clorosa (nox +3) Cl2O3 (non è nota)
anidride clorica (nox +5) Cl2O5 (non è nota)
anidride perclorica (nox +7) Cl2O7
Con nox +4 forma il biossido di cloro ClO2
Bromo (+1, +5) anidride ipobromosa (nox +1) Br2O
anidride bromica (nox +5) Br2O5 (non è nota)
con nox +4 forma il biossido di bromo BrO2
Iodio (+1, +5, +7) anidride ipoiodosa (nox +1) I2O (non è nota)
anidride iodica (nox +5) I2O5
anidride periodica (nox +7) I2O7 (non è nota)
Il fluoro con nox -1 forma con l'ossigeno un composto estremamente instabile, l'ossido di fluoro F2O(dove l'ossigeno presenta nox +2). In realtà, essendo il fluoro più elettronegativo, andrebbe scritto OF2 e considerato un fluoruro di ossigeno.
VI gruppo A |
Zolfo (+4, +6) anidride solforosa (nox +4) SO2
anidride solforica (nox + 6) SO3
con i numeri di ossidazione +2 e +3 forma il protossido di zolfo SO e l'anidride iposolforosa (sesquiossido) S2O3.
Selenio (+4, +6) anidride seleniosa (nox +4) SeO2
anidride selenica (nox +6) SeO3
Tellurio (+4, +6) anidride tellurosa (nox +4) TeO2
anidride tellurica (nox +6) TeO3 (non è nota)
V gruppo A |
Azoto (+3, +5) anidride nitrosa (nox +3) N2O3
anidride nitrica (nox +5) N2O5
Con nox +4 forma l'ipoazotide N2O4, in equilibrio con il biossido di azoto NO2 (può essere considerato un'anidride mista nitroso-nitrica, infatti in acqua da una miscela di acido nitroso e nitrico)
con nox +2 forma il monossido di azoto NO (o ossido nitrico)
con nox +1 il protossido di azoto N2O (gas esilarante) o anidride iponitrosa (o ossido nitroso).
Fosforo (+3, +5) anidride fosforosa (nox +3) P2O3 (in realtà P4O6)
anidride fosforica (nox +5) P2O5 (in realtà P4O10)
con nox +4 forma il tetrossido di fosforo P2O4, analogo all'ipoazotide (in acqua da una miscela di acido fosforoso e fosforico)
Le anidridi degli altri tre elementi appartenenti al quinto gruppo (arsenico, antimonio e bismuto) possono essere anche classificati come ossidi dato il comportamento anfotero di tali composti.
Arsenico (+3, +5) anidride (o ossido) arseniosa ( nox +3) As2O3 (in realtà As4O6)
anidride (o ossido) arsenica ( nox +5) As2O5
con nox +4 forma il tetrossido di arsenico As2O4, analogo all'ipoazotide (può essere considerata un'anidride mista arsenioso-arsenica, infatti in acqua da una miscela dei due acidi corrispondenti)
Antimonio (+3, +5) anidride (o ossido) antimoniosa (nox +3) Sb2O3 (in realtà Sb4O6)
anidride (o ossido) antimonica (nox +5) Sb2O5
con nox +4 forma il tetrossido di antimonio Sb2O4, che si ritiene sia un ossido salino simile al minio o antimoniato antimonioso Sb3+(SbO4)3-.
Bismuto (+3, +5) ossido di bismuto (nox +3) Bi2O3
anidride (o ossido) bismutica (nox +5) Bi2O5
con nox +4 forma il tetrossido di antimonio Bi2O4.
IV gruppo A |
Carbonio (+2, +4) ossido di carbonio (nox +2) CO
anidride carbonica (nox +4) CO2
Silicio (+4) anidride silicica (o biossido) SiO2
Germanio (+4) Anidride germanica (o biossido) GeO2
III gruppo A |
Boro (+3) Anidride borica (o ossido) B2O3
VI gruppo B |
Principali anidridi dei gruppi B
Cromo (+2, +3, +6) anidride cromica (nox + 6) CrO3
con nox +2 e +3 forma due ossidi
VII gruppo B |
Manganese (+2, +3, +4, +6, +7) anidride permanganica (nox +7) Mn2O7
con i nox più bassi forma tre ossidi (con nox + 6 i manganati)
Gli idracidi sono composti binari dei non metalli con l'idrogeno.
I principali idracidi si formano dall'unione dell'idrogeno con i non metalli del VII gruppo A (alogeni) e con i non metalli del VI gruppo A.
Il nome degli idracidi si forma facendo seguire al termine "acido" il nome del non metallo seguito dalla desinenza -idrico.
Negli idracidi del VII gruppo A i non metalli presentano sempre nox -1
acido fluoridrico HF
acido cloridrico HCl (acido muriatico)
acido bromidrico HBr
acido Iodidrico HI
Negli idracidi del VI gruppo A i non metalli presentano nox -2
acido solfidrico H2S
acido selenidrico H2Se
acido telluridrico H2Te
Altri idracidi sono
l'acido cianidrico HCN HCN
l'acido azotidrico HN3 HNNN
Altri composti idrogenati binari sono
l'ammoniaca NH3
la fosfina PH3
l'arsina AsH3
Ossidi e anidridi reagiscono con l'acqua per dare due importanti classi di composti ternari, gli idrossidi e gli acidi ossigenati o ossiacidi, i quali oltre a contenere ossigeno contengono evidentemente anche idrogeno.
Gli acidi sono sostanze che, sciolte in acqua, tendono a dissociarsi in un anione e in uno o più ioni H+.
Gli idrossidi sono sostanze a carattere basico che, sciolte in acqua, tendono a dissociarsi in un catione e in uno o più anioni ossidrile OH-.
Un composto ternario che contenga idrogeno e ossigeno viene convenzionalmente scritto in modo diverso a seconda che presenti un carattere acido o basico.
Se si tratta di un acido vengono messi in evidenza gli atomi di idrogeno, scrivendo per primo l'idrogeno seguito dal simbolo chimico del non metallo X ed infine dall'ossigeno.
ACIDO HnXmOl
se si tratta di un idrossido vengono messi in evidenza i gruppi ossidrili, scrivendo per primo il simbolo dell'elemento metallico Y seguito da tanti gruppi ossidrili racchiusi tra parentesi tonde, quanti ne richiede il numero di ossidazione "n" del metallo.
IDROSSIDO Y(OH)n
Alcuni composti possono comportarsi come acido o come base, a seconda delle condizioni di reazione. Sono detti composti anfoteri e la loro formula chimica può essere scritta come quella di un acido o come quella di un idrossido in realazione alla particolare comportamento che presentano in una data reazione.
Gli acidi si formano sommando una o più molecole d'acqua ad un'anidride
Anidride + acqua = Acido
Il carattere acido di queste sostanze, cioè la loro tendenza a liberare ioni H+, è legato alla presenza nella molecola di un non metallo, un elemento elettronegativo che attirando gli elettroni di legame li allontana dagli atomi di idrogeno. Sugli atomi di idrogeno si forma una parziale, ma intensa carica positiva che ne facilita la liberazione come ioni H+, una volta in acqua.
Il nome degli acidi si ottiene da quello dell'anidride corrispondente, sostituendo il termine "acido" al termine "anidride".
Per costruire un acido è sufficiente sommare all'anidride 2 atomi di idrogeno e 1 di ossigeno per ogni molecola d'acqua che viene aggiunta.
Ad esempio dall'anidride carbonica si ottiene l'acido carbonico
CO2 + H2O → H2CO3
mentre dall'anidride nitrica si ottiene l'acido nitrico
N2O5 + H2O → H2N2O6 → 2HNO3
Forza di un acido
Un acido si dice forte quando in soluzione acquosa è completamente o quasi completamente dissociato in anioni e ioni H+, si dice debole quando è poco dissociato. La forza di un acido si può prevedere in linea di massima, osservando il numero di atomi di idrogeno e di ossigeno presenti nella sua molecola. Un acido può ritenersi forte quando la differenza tra il numero di atomi di ossigeno ed il numero di atomi di idrogeno è uguale o maggiore di due, debole in caso contrario. Così mentre l'acido carbonico è debole, l'acido nitrico è forte.
Dissociazione di un acido
Un acido con un solo atomo di idrogeno è detto monoprotico, con due biprotico etc.
Una acido monoprotico come l'acido nitrico si dissocia in acqua
HNO3 → H+ + NO3-
un acido poliprotico presenta invece tante dissociazioni quanti sono gli atomi di idrogeno contenuti nella sua molecola. L'acido carbonico ad esempio può dare due dissociazioni
H2CO3 → H+ + HCO3-
HCO3- → H+ + CO32-
Naturalmente è possibile scrivere l'intera dissociazione in forma sintetica
H2CO3 → 2H+ + CO32-
Proviamo ora a costruire le formule dei principali ossiacidi gruppo per gruppo, tenendo presente che non tutte le reazioni che scriveremo tra anidride e acqua possono effettivamente avvenire. Esse ci servono unicamente per ottenere la formula corretta dei diversi acidi. Si tenga inoltre presente che non tutte le anidridi e non tutti gli acidi che scriveremo sono stati effettivamente isolati. Alcuni sono solo teorici e ci servono per poter poi costruire correttamente le formule dei composti salini che da essi derivano.
VII gruppo A |
Il Cloro con i numeri di ossidazione +1, +3, +5 e +7 forma i seguenti acidi
Cl2O + H2O → H2Cl2O2 → 2HClO acido ipocloroso (esiste solo in soluzione)
Cl2O3 + H2O → H2Cl2O4 → 2HClO2 acido cloroso (esiste solo in soluzione)
Cl2O5 + H2O → H2Cl2O6 → 2HClO3 acido clorico (esiste solo in soluzione)
Cl2O7 + H2O → H2Cl2O8 → 2HClO4 acido perclorico
Il Bromo con i numeri di ossidazione +1 e +5 forma i seguenti acidi
Br2O + H2O → H2Br2O2 → 2HBrO acido ipobromoso
Br2O5 + H2O → H2Br2O6 → 2HBrO3 acido bromico
Lo Iodio con i numeri di ossidazione +1, +5 e +7 forma i seguenti acidi
I2O + H2O → H2I2O2 → 2HIO acido ipoiodoso (teorico, esistono i suoi sali)
I2O5 + H2O → H2I2O6 → 2HIO3 acido iodico
I2O7 + H2O → H2I2O8 → 2HIO4 acido periodico
VI gruppo A |
Lo zolfo con i numeri di ossidazione +4 e +6 forma i seguenti acidi
SO2 + H2O → H2SO3 acido solforoso (esiste solo in soluzione)
SO3 + H2O → H2SO4 acido solforico
Altri acidi dello zolfo
a partire dal protossido di zolfo con numero di ossidazione +2 si ottengono 2 diversi acidi
SO + H2O → H2SO2 acido solfossilico (teorico, esistono i suoi sali)
2SO + H2O → H2S2O3 acido tiosolforico (teorico, esistono i suoi sali chiamati erroneamente iposolfiti). Il nome rimanda al fatto che la sua struttura chimica è analoga a quella dell'acido solforico, dove un atomo di ossigeno è stato sostituito da uno di zolfo (il radicale S2- si indica con il suffisso tio-).
A partire dal sesquiossido di zolfo con nox +3 si ottiene
S2O3 +H2O → H2S2O4 acido iposolforoso (o idrosolforoso) (esiste solo in soluzione)
Per reazione tra due molecole di acido solforoso, con perdita di una molecola d'acqua si ottiene
2H2SO3 → H2S2O5 +H2O acido pirosolforoso (teorico, esistono solo i suoi sali)
Per reazione tra due molecole di acido solforico, con perdita di una molecola d'acqua si ottiene
2H2SO4 → H2S2O7 +H2O acido pirosolforico o disolforico
Lo zolfo presenta inoltre, con nox +6, due perossidi tipo acqua ossigenata, che sarebbe opportuno chiamare peranidridi, S2O7 e SO4, le cui formule di struttura potrebbero essere

tali composti possono dare due peracidi o perossiacidi (acidi in cui è presente il gruppo OO)
S2O7 + H2O → H2S2O8 acido dipersolforico
SO4 + H2O → H2SO5 acido monopersolforico
Lo zolfo è infine in grado di dare legami SS simili a quelli dell'ossigeno nei perossidi, formando quindi dei persolfuri. Tale caratteristica è ancora più spiccata nello zolfo in quanto esso è in grado di dare anche catene formate da più atomi. Sono noti due persolfuri d'idrogeno: analogo all'acqua ossigenata esiste HSSH e anche HSSSH i due composti sono noti rispettivamente come:
H2S2 disolfuro d'idrogeno H2S3 trisolfuro d'idrogeno
Sfruttando lo stesso tipo di legame tra atomi zolfo si forma anche una famiglia di acidi politionici, di formula generale H2SxO6, dove x = 2, 3, 4, 5,..... con formula di struttura
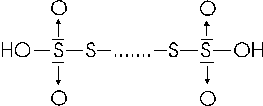
essi vengono denominati acido ditionico, tritionico, tetrationico etc.
Il Selenio con numeri di ossidazione +4 e +6 forma i seguenti acidi
SeO2 + H2O → H2SeO3 Acido selenioso
SeO3 + H2O → H2SeO4 Acido selenico
V gruppo A |
L'Azoto con i numeri di ossidazione +3 e +5 produce i seguenti acidi
N2O3 + H2O → H2N2O4 → 2HNO2 acido nitroso
N2O5 + H2O → H2N2O6 → 2HNO3 acido nitrico
Altri acidi dell'azoto
Facendo reagire l'acido nitrico con l'acqua ossigenata si ottiene un peracido o perossiacido (contenente il gruppo OO), detto acido pernitrico, dove l'azoto presenta nox +5
HNO3 + H2O2 HNO4 + H2O
con formula di struttura 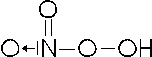
Facendo reagire l'anidride nitrosa con l'acido solforico si ottiene l'acido nitrosil-solforico (il suffisso nitrosil- indica la presenza del gruppo nitrosile NO)
N2O3 + 2H2SO4 2NOHSO4 + H2O
L'acido nitrosil-solforico può essere pensato come prodotto dalla disidratazione (perdita di acqua) tra una molecola di acido solforico ed una di acido nitroso
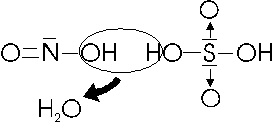
Il Fosforo con i numeri di ossidazione +3 e + 5 forma una serie di acidi che presentano diversi gradi di idratazione.
In particolare quando un'anidride si lega con una sola molecola d'acqua l'acido che ne deriva viene indicato facendone precedere il nome dal suffisso meta-.
Quando viene legata una seconda molecola d'acqua al meta-acido si forma un acido il cui nome viene preceduto dal prefisso orto-.
P2O3 + H2O → H2P2O4 → 2HPO2 acido metafosforoso
HPO2 + H2O → H3PO3 acido ortofosforoso
P2O5 + H2O → H2P2O6 → 2HPO3 acido metafosforico
HPO3 + H2O → H3PO4 acido ortofosforico
L'acido ortofosforoso, pur avendo 3 idrogeni, è biprotico, ne dissocia cioè solo due. Per questo motivo si ritiene che un idrogeno sia legato direttamente all'atomo di fosforo, piuttosto che ad un ossigeno.
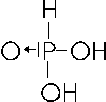
Con il numero di ossidazione +5 il fosforo forma anche l'acido pirofosforico (o difosforico) il quale si forma per disidratazione (perdita di una molecola d'acqua) da due molecole di acido ortofosforico.
Per trovarne la formula in maniera più rapida e veloce è sufficiente aggiungere due molecole d'acqua all'anidride fosforica
P2O5 + 2H2O → H4P2O7 acido pirofosforico
Altri acidi del fosforo
Con il nox +5 il fosforo forma due peracidi o perossiacidi in cui è presente il gruppo OO.
H3PO5, acido monoperfosforico e H4P2O8, acido diperfosforico, con formule di struttura

Il tetrossido di fosforo P2O4, analogo all'ipoazotide, dove il fosforo presenta nox +4, sciolto in acqua forma una miscela di acido fosforoso e fosforico. Esiste comunque un acido in cui il fosforo presenta nox +4 e di cui il tetrossido rappresenta l'anidride teorica. E' l'acido ipofosforico H4P2O6, la cui formula può essere ottenuta aggiungendo due molecole d'acqua al tetrossido.
Esiste infine anche un acido ipofosforoso H3PO2, in cui il fosforo presenta nox +1. Corrisponde ad un protossido di fosforo P2O, non conosciuto.
L'Arsenico con i numeri di ossidazione +3 e +5 produce i seguenti acidi
As2O3 + H2O → 2HAsO2
HAsO2 + H2O → H3AsO3 acido ortoarsenioso (esiste solo in soluzione)
As2O5 + H2O → 2HAsO3
HAsO3 + H2O → H3AsO4 acido ortoarsenico
L'acido ortoarsenioso è un composto anfotero. In soluzioni basiche si comporta come un acido, mentre in soluzioni acide si comporta come una base, dissociandosi in ioni OH- e cationi As3+. In tal caso esso va scritto come un idrossido arsenioso
As(OH)3 → As3+ + 3OH-
Esiste infine, analogamente a quanto visto per il fosforo, un acido piroarsenico, ottenibile per disidratazione di due molecole di acido ortoarsenico. La sua formula può essere determinata più facilmente sommando due molecole d'acqua all'anidride arsenica
As2O5 + 2H2O → H4As2O7 acido piroarsenico
IV gruppo A |
Il Carbonio con il numero di ossidazione +4 forma l'acido carbonico
CO2 + H2O → H2CO3 acido carbonico (esiste solo in soluzione)
E' noto anche un peracido, l'acido percarbonico, H2C2O6 dalla formula di struttura
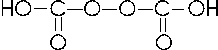
Il Silicio con numero di ossidazione +4 forma due acidi
SiO2 + H2O → H2SiO3 acido metasilicico
H2SiO3 + H2O → H4SiO4 acido ortosilicico
L'acido silicico dà poi per disidratazione una serie di acidi polisilicici, rappresentabili dalla formula generale (mH4SiO4 nH2O). Il primo termine della serie è l'acido ortodisilicico o pirosilicico
2H4SiO4 → H6Si2O7 + H2O acido pirosilicico
III gruppo A |
Il Boro con nox +3 forma l'acido borico ed un peracido, l'acido perborico
B2O3 + H2O → 2HBO2 acido metaborico
HBO2 + H2O → H3BO3 acido ortoborico
l'acido perborico (o perossiborico) HBO3, ha formula di struttura
![]()
Scaldando l'acido ortoborico si ottiene infine per disidratazione un poliacido
4H3BO3 → H2B4O7 + 4H2O acido tetraborico
PRINCIPALI ACIDI DEI GRUPPI B
VI gruppo B |
Il Cromo (nox +2, +3, +6) forma composti acidi con il numero di ossidazione più elevato
CrO3 + H2O → H2CrO4 acido cromico (esiste solo in soluzione)
Trattando le soluzioni di acido cromico con acqua ossigenata si ottengono diversi tipi di peracidi, acidi percromici e i relativi sali (i percromati).
Esiste infine una serie di sali che derivano da acidi policromici (teorici), il primo termine della serie è l'acido bicromico
2H2CrO4 → H2Cr2O7 + H2O acido bicromico (teorico, esistono i suoi sali)
VII gruppo B |
Il Manganese (nox +2, +3, +4, +6, +7) forma composti acidi con i due numeri di ossidazione più elevati
Con il nox + 6 forma un acido manganico (teorico), la cui formula è ottenibile da un'anidride manganica MnO3, altrettanto teorica.
MnO3 + H2O → H2MnO4 acido manganico (teorico, esistono i suoi sali)
Mn2O7 + H2O → H2Mn2O8 2HMnO4 acido permanganico
Gli idrossidi si formano sommando una o più molecole d'acqua ad un ossido
Ossido + acqua = Idrossido
Il carattere basico di queste sostanze, cioè la loro tendenza a liberare ioni OH-, è legato alla presenza nella molecola di un metallo, che rende polare il legame con i gruppi ossidrilici. Sull'atomo di ossigeno dell'ossidrile si intensifica in tal modo la parziale carica negativa, mentre sul metallo si forma una parziale carica positiva che ne facilita la liberazione come catione, una volta in acqua, e la separazione dei gruppi OH-.
Il nome degli idrossidi si ottiene da quello dell'ossido corrispondente, sostituendo il termine "idrossido" al termine "ossido".
Per costruire un idrossido è sufficiente far seguire al metallo tanti gruppi ossidrili quanti ne richiede il numero di ossidazione del metallo.
Ad esempio dall'ossido di potassio si ottiene l'idrossido di potassio
K2O + H2O → 2KOH
mentre dall'ossido di rame si ottiene l'idrossido di rame
CuO + H2O → Cu(OH)2
Forza di un idrossido
Un idrossido si dice forte quando in soluzione acquosa è completamente o quasi completamente dissociato in cationi e ioni OH-, si dice debole quando è poco dissociato. La forza di un idrossido si può prevedere in linea di massima, osservando se il metallo appartenga o meno ad uno dei primi gruppi chimici. In linea di massima un idrossido è forte quando il metallo che lo forma è un metallo alcalino o alcalino-terroso. Così mentre l'idrossido di rame è debole, l'idrossido di potassio è forte.
Dissociazione di un idrossido
Un idrossido con un solo gruppo ossidrile è detto monoprotico, con due biprotico etc.
Un idrossido monoprotico come l'idrossido di potassio si dissocia in acqua
KOH → K+ + OH-
un idrossido poliprotico presenta invece tante dissociazioni quanti sono i gruppi ossidrile contenuti nella sua molecola. L'idrossido di rame può dare due dissociazioni
Cu(OH)2 → CuOH+ + OH-
CuOH- → Cu2+ + OH-
Naturalmente è possibile scrivere l'intera dissociazione in forma sintetica
Cu(OH)2 → Cu2+ + 2OH-
Proviamo ora a costruire le formule dei principali ossiacidi gruppo per gruppo
I gruppo A |
I metalli alcalini hanno tutti nox +1 e quindi formano idrossidi del tipo LiOH, NaOH, KOH etc
II gruppo A |
I ma talli alcalino-terrosi hanno tutti nox +2 e formano quindi idrossidi del tipo Be(OH)2, Mg(OH)2 etc
III gruppo A |
I metalli del terzo gruppo A presentano tutti nox +3 e formano quindi idrossidi del tipo Al(OH)3 etc
L'idrossido di alluminio è in realtà un composto anfotero.
In soluzione acida si comporta infatti come una base, mentre in soluzione basica si comporta come un acido (acido alluminico)
H3AlO3 → AlO33- + 3H+
IV gruppo A |
I metalli del quarto gruppo formano idrossidi con nox +2 e +4
Lo stagno con nox +2 forma l'idrossido stannoso Sn(OH)2, avente carattere anfotero (acido stannoso, H2SnO2). Con nox +4 forma invece un composto a carattere acido
SnO2 + H2O → H2SnO3 acido stannico
Il Piombo, con nox +2 forma l'idrossido piomboso Pb(OH)2, a carattere anfotero (acido piomboso H2PbO2). Con nox +4 forma l'idrossido piombico Pb(OH)4, anch'esso anfotero (acido piombico H4PbO4).
Fonte: http://www.pianetachimica.it/didattica/documenti/Chimica_Generale.doc
Sito web da visitare: http://www.pianetachimica.it
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve