I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
CHIMICA INORGANICA
Atomo:
L’atomo è la più piccola particella di materia che ne presenta tutte le caratteristiche sia fisiche che chimiche. Risulta costituito da centinaia di particelle subatomiche di cui solo 3 presentano caratteristiche fondamentali ai fini dei comportamenti dell’atomo:

Numero di Avogadro:
Indicato con il simbolo NA o N0, è il numero di particelle contenute in una mole di qualunque sostanza o, alternativamente, il numero di atomi contenuti in 12 g di 12C. Esso risulta identico considerando una mole di qualunque sostanza. Le prime stime del numero di Avogadro divennero possibili alla fine dell'Ottocento, dopo che il concetto di mole fu esteso alle sostanze liquide e solide (in qualunque gas un mole equivale a 22,4 l); attualmente si assume il valore 6,022 × 1023, calcolato come media approssimata dei dati ottenuti mediante metodi sperimentali chimici e fisici indipendenti.
Mole:
La mole di una sostanza è la quantità in g pari al numero che esprime la sua massa molecolare relativa. In essa è contenuto un numero di molecole che è espresso dal numero di Avogadro.
Massa atomica:(a volte detta anche peso atomico) Spesso in questo caso i termini peso e massa sono utilizzati indistintamente anche se indicano concetti fisici molto diversi.
La massa atomica è un valore che indica la massa di un singolo atomo. Tale valore può essere espresso in maniera assoluta o relativa. La massa atomica assoluta indica la massa effettiva di un atomo (espresso in g) di un elemento. La massa atomica relativa indica quante volte un atomo dell’elemento pesa rispetto all’u.m.a. (Unità di Massa Atomica, corrispondente ad un dodicesimo della massa dell'isotopo 12C). E’ questo un numero adimensionale, cioè relativo ad una misura non espressa nel sistema metrico decimale.
Numero atomico, numero di massa, nuclidi, isotopi :
Il numero atomico (Z) indica il numero di protoni contenuti in un atomo. In un atomo
neutro il numero atomico indica anche il numero di elettroni.
Il numero di massa (A) esprime il numero totale di protoni e neutroni contenuti in un atomo.
Il numero di neutroni può essere dato dalla differenza A–Z.
Il nuclide è un atomo contrassegnato dal suo numero atomico e dal suo numero di massa. Esso si indica scrivendo in alto a sinistra il numero di massa ed in basso a sinistra il numero atomico.
Il numero di neutroni è estremamente variabile da un atomo di un elemento all’altro; aumenta con l’aumentare del numero di protoni senza una regola fissa o di stretta proporzionalità.
Gli isotopi sono nuclidi che presentano lo stesso numero atomico (Z) ma un diverso numero di massa. Gli elementi presenti in natura sono, di solito, un misto di vari isotopi. Esempi di isotopi sono: 12C, 13C e 14C ( Carbonio a 6, 7 o 8 neutroni nel nucleo) e gli isotopi dell’idrogeno, che presentano anche nomi diversi per ogni isotopo, protio, deuterio e tritio (rispettivamente i nuclidi 1H, 2H e 3H).
Modello atomico:
Il primo modello atomico fu proposto da Thomson nel 1899, e secondo questo le particelle dotate di carica erano disposte tutte in maniera uniforme nell’atomo, come se le particelle dotate di carica positiva fossero sospese in un indistinto insieme di carica negativa.
Successivamente Rutherford propose un modello secondo cui protoni e neutroni erano disposti nel nucleo, mentre gli elettroni erano liberi di muoversi attorno al nucleo stesso, avendo scoperto che gran parte dello spazio occupato da un atomo è costituito dal vuoto che intercorre tra il nucleo e gli elettroni.
La teoria più accreditata rimane quella di Bohr, secondo cui gli elettroni si muovono attorno al nucleo (in cui sono contenuti protoni e neutroni) descrivendo delle orbite stazionarie ben delimitate.
Orbitale:
L’orbitale è la regione dello spazio intorno al nucleo dove la probabilità di riscontrare la presenza di un elettrone è massima.
Il principio di indeterminazione di Heisenberg:
Date le caratteristiche dell’elettrone, Heisemberg formulò il suo principio di indeterminazione, secondo cui è impossibile determinare con eguale precisione la velocità e la posizione dell’elettrone all’interno del suo orbitale.
L’equazione di Schroedinger:
Il moto di un elettrone all’interno di un orbitale è descritto da un’equazione d’onda che tiene conto della continuità dell’onda descritta dall’elettrone, della stazionarietà dell’onda nel tempo (cioè della sua non mutevolezza). L’equazione di Schroedinger è risolvibile mediante l’introduzione di tre costanti: n, l ed m (definite numeri quantici).
Numeri quantici:
Gli orbitali atomici e le caratteristiche degli elettroni di un atomo dipendono dai 4 valori detti numeri quantici. Si distinguono:
1. numero quantico principale (n) caratterizza lo stato energetico dell’orbitale in base alla sua distanza dal nucleo. Può assumere valori interi compresi tra 1 e 7.
2. numero quantico secondario (detto anche azimutale o angolare) (l) riguarda la forma dell’orbitale. Può assumere valori compresi tra 0 ed n–1. Le forme degli orbitali sono s, p, d, f.
3. numero quantico magnetico (m) esprime l’orientazione spaziale dell’orbitale. Può assumere tutti i valori compresi tra – l ed l.
4. numero quantico di spin (s) indica il senso di rotazione dell’elettrone. Assume solo valori che siano – ½ o + ½.

Principio di esclusione di Pauli:
Il principio di esclusione di Pauli (1925) afferma che gli elettroni di uno stesso atomo non possono a vere tutti e 4 i numeri quantici uguali (almeno uno deve essere diverso).
Regola di Hund:
La regola di Hund, o principio della massima molteplicità afferma che gli elettroni si dispongono ad occupare il massimo numero di orbitali in un sottolivello.
Principio di Aufbau:
Per il principio di Aufbau, gli elettroni tendono ad occupare gli orbitali seguendo l’ordine di
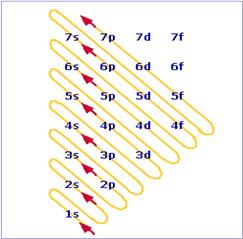
energia crescente.
Stato fondamentale di un atomo:
È detto stato fondamentale di un atomo quello in cui questo non è eccitato, e quindi neutro.
Tavola periodica:
Tutti gli elementi presenti in natura sono stati raggruppati nella cosiddetta tavola periodica a lunghi periodi, in cui essi sono stati ordinati in base a numero atomico crescente e disposti secondo 7 righe orizzontali (periodi) e 16 colonne verticali (gruppi).
Il gruppo IA comprende i metalli alcalini, il gruppo IIA i metalli alcalino-terrosi, il gruppo IIIA viene chiamato gruppo del boro, il gruppo IVA gruppo del carbonio, il gruppo VA gruppo dell’azoto, il gruppo VIA gruppo dell'ossigeno o calcogeni, il gruppo VIIA gli alogeni, il gruppo 0 i gas nobili.
Energia di ionizzazione:
Viene definita energia di ionizzazione l’energia necessaria per allontanare l’elettrone più debolmente legato all’atomo isolato allo stato gassoso e portarlo all’infinito. Tale energia dipende dalla carica nucleare effettiva e dal raggio atomico. Se il numero di protoni è maggiore di quello di elettroni, allora si parla di catione es. K+, in una condizione contraria, abbiamo anioni es. Cl-.
Affinità elettronica:
L’affinità elettronica è definita come l’energia che viene liberata quando un elettrone viene acquistato da un atomo neutro allo stato gassoso. Come l’energia di ionizzazione, anche l’affinità elettronica dipende dalla carica nucleare effettiva e dal raggio atomico.
Elettronegatività:
La grandezza che raccoglie sia gli effetti dell’energia di ionizzazione che dell’affinità elettronica è l’elettronegatività. Viene definita come la tendenza di un atomo ad attrarre
verso di sé gli elettroni di legame. Un elemento è elettronegativo se nelle sue interazioni
con altri elementi tende ad acquistare elettroni.
L’elemento più elettronegativo è il Fluoro (4), seguito dall’Ossigeno (3,5) e dall’Azoto (3). Il più elettropositivo è il Francio.
Legami chimici:
Un legame chimico è l’insieme delle forze che tengono uniti due o più atomi fra loro in un assetto stabile di minore energia. Questa configurazione è composta da 8 elettroni ed è indicata anche con il termine di ottetto. I legami si distinguono in deboli e forti: i deboli sono i legami ad idrogeno (2-7 kcal/mol) e le forze di Van der Waals (1-4 kcal/mol), mentre i forti hanno energia compresa tra 50 e 250 kcal/mol.
Si elencano qui di seguito i legami chimici:
1. legame ionico: è una forza di natura elettrostatica che si stabilisce tra due ioni di carica opposta e si forma a seguito di un trasferimento reale di elettroni da un atomo all’altro. Non si può mai formare tra atomi dello stesso tipo.
2. legame covalente: si forma quando la configurazione stabile dell’ottetto si raggiunge attraverso la compartecipazione tra atomi di due o più elettroni. Se gli atomi sono simili, il legame si definisce covalente omeopolare. Quando gli elettroni sono 1 coppia, si parla di legame covalente semplice; nel caso in cui le coppie di elettroni siano 2 o 3, il legame viene definito doppio o triplo.
3. legame dativo: si instaura tra due atomi di cui ve ne sia uno che cede elettroni (donatore) ed uno che li acquista (accettore). Es. nello ione ammonio
4. legame metallico: poiché i metalli presentano nel loro strato più esterno pochi elettroni da mettere in compartecipazione con altri atomi dello stesso tipo per formare l’ottetto, trovano più agevole liberarsi degli elettroni esterni, diventando cationi.
5. legame a idrogeno: è anch’esso un legame di natura elettrostatica, si forma quando un atomo di idrogeno è condiviso tra due atomi fortemente elettronegativi che fanno parte di due molecole o raggruppamenti diversi. Il più tipico è quello che si verifica per le molecole d'acqua.
6. forze di Van der Waals: si tratta di deboli forze di natura elettrostatica che possono stabilirsi tra molecole originariamente non polari (dipolo istantaneo, indotto, permanente).
Fonte: http://www.montefenera.org/scienze/chimica/chimica_generale_ripasso_rivisto.doc
Sito web da visitare: http://www.montefenera.org/
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve