I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
La Chimica dell’ambiente
La chimica dell’ambiente è quella disciplina, che studia i processi chimici che avvengono nell’acqua, nel suolo, nell’atmosfera con lo scopo di scoprire le fonti, le reazioni, il trasporto e gli effetti delle diverse sostanze chimiche.
La Chimica dell’Ambiente
non si identifica né con la chimica analitica, né con la chimica inorganica, organica o chimica fisica,
è un approccio globale che, avvalendosi delle esperienze delle varie specializzazioni della chimica tradizionale, cerca di ottenere un
quadro il più possibile preciso e dettagliato dei fenomeni chimici che avvengono nell’ambiente includendo sia quelli naturali che quelli indotti dalle attività umane
Per questa sua natura la Chimica dell’ambiente è una disciplina di frontiera; ha infatti strette relazioni con
la biologia, in quanto gli organismi viventi influenzano e sono influenzati dai fenomeni chimici,
con l'ecologia in quanto la crescita di popolazioni di organismi è vincolata alla disponibilità di composti chimici come i nutrienti,
con la geologia perché la natura chimica di un corpo d'acqua dipende dalla formazioni rocciose con cui è a contatto,
con l'idrologia, la statistica ecc.
Programma
Gli argomenti principali sono:
Proprietà dell'acqua e dei corpi d'acqua
I fondamenti della chimica dell'acqua:
Equilibri acido-base e di complessamento
Sistemi ossido-riduttivi
Interazioni di fase: Solubilità-Formazione di sedimenti
Il ruolo degli organismi nei processi chimici delle acque: cicli degli elementi principali: carbonio, azoto, zolfo…
Inquinamento delle acque
Trattamento delle acque
Questi argomenti sono trattati nel presente corso
Attività didattica integrativa:
Visita ad Impianto di potabilizzazione (Ca’ Solaro) e ad Impianto di Trattamento acque urbane (Fusina)
2 - La chimica dell’acqua di mare:
Corso della laurea magistrale: Chimica del mare
Chimica dell’ambiente applicata al mare
3 - La chimica dell'atmosfera
Corso della laurea magistrale: Chimica dell’atmosfera
L'atmosfera e la chimica atmosferica
Il particolato atmosferico
Inquinanti inorganici gassosi
Inquinanti organici dell'aria
Lo smog fotochimico (inquinamento urbano)
I danni causati all'atmosfera su scala globale: pioggia acida, effetto serra, Buco dell’ozono stratosferico.
Bibliografia del corso
Testi base:
S. E. Manahan, Environmental Chemistry, Lewis Pub. Boca Raton, FLA, 2009, IX Ed.
Ediz. Ital. Chimica ambientale sulla VI Ediz., Piccin Editore, Padova, 2000.
C. Baird, Environmental Chemistry, W.E. Freemand and Company, N.Y., 1995.
Ediz. Ital. Chimica ambientale Edit. Zanichelli, Bologna, 2006.
Testi di riferimento e/o approfondimento:
S. M. Libes, An introduction to marine biogeochemistry, J. Wiley & Sons, N.Y, 1992.
W. Stumm, J.J. Morgan, Aquatic chemistry, III Ed., J. Wiley and Sons N.Y.I 1995.
B. J. Finlayson‑Pitts, J.N. Pitts, Atmospheric chemistry, J. Wiley and Sons, N.Y.,1986.
M. Amdur, J. Doull, C. Klaassen, Casarett and Doull’s Toxicology, Mc Graw Hill, N.Y., 1991.
F. Millero, Chemical Oceanography, CRC Press, Boca Raton, 1996.
G. Vollmer, M. Franz, La chimica di tutti i giorni. Zanichelli, Bologna, 1994.
E. Roques, Chemical water treatment. Principles and practice, VCH Publisher, N.Y., 1995.
J. M. Bokris, Environmental Chemistry, Plenum Press, N.Y., 1977.
Cultura personale:
R. Carson, Primavera silenziosa, Feltrinelli, 1976.
Cap. 2. Proprietà dell'acqua e dei corpi d'acqua
La qualità e la quantità di acqua disponibile sono stati e sono fattori di vitale importanza per il benessere degli uomini.
In passato: Cambiamenti climatici che hanno portato a scarsità d'acqua hanno causato la scomparsa di intere civiltà. Es. Sahara
Il consumo di acqua infetta ha causato l'insorgenza di gravi epidemie di tifo e colera, che hanno decimato intere popolazioni
Ai giorni nostri: Siccità spaventose succedutesi in Africa negli anni 1980 hanno causato catastrofiche perdite di raccolti e carestie.
Verso la fine del 1990, nel quinto consecutivo anno di siccità è stata necessaria l'imposizione del razionamento dell'acqua in California.
Epidemie di colera, originate dal consumo di acqua infetta, sono scoppiate recentemente in paesi meno sviluppati.
Al presente:
I problemi legati alla disponibilità di acqua di buona qualità e abbondante, stanno diventando più seri, in quanto
aumentano i consumi di acqua con l'aumento della popolazione,
aumentano i rischi di contaminazione dell'acqua potabile per lo scarico improprio di sostanze pericolose,
aumenta l'esposizione degli animali selvatici ad acque inquinate.
Questo capitolo tratta in generale le proprietà dell'acqua e dei corpi d'acqua, siano essi fiumi, laghi, estuari e oceani,
Nei capitoli seguenti saranno sviluppati in dettaglio i vari aspetti relativi al pH dell’acqua, le reazioni ossido-riduttive, la solubilità.
In Fig. 2.1 viene riportato schematicamente il ciclo globale dell'acqua.
A livello planetario, l'acqua si trova:

negli oceani;
come vapore nell'atmosfera (nubi);
allo stato solido come ghiaccio e neve in ghiacciai, calotte polari;
come acqua di superficie in laghi, corsi d'acqua e bacini,
come acqua profonda in falde sottoterra.
Le attività umane intervengono significativamente nel modificare le relazioni tra l'idrosfera e la litosfera o terra.
Per esempio,
la trasformazione di pascoli o foreste in terre coltivabili e
l'intensificazione della produzione agricola con l’uso massiccio di fertilizzanti
possono ridurre la copertura vegetativa,
diminuendo la traspirazione (perdita di acqua da parte delle piante)
e causando un cambiamento del microclima.
Ne derivano come conseguenze:
riduzione della captazione→ impoverimento delle falde→ abbassamento dei livelli→ inquinamento delle falde.
L'acqua per uso umano
è principalmente acqua dolce di superficie e sotterranea.
In regioni costiere aride parte dell'acqua viene anche dagli oceani ; è resa potabile con processi di desalinizzazione.
Questa fonte probabilmente diverrà più importante in futuro dal momento che la disponibilità mondiale di acqua dolce diviene sempre più scarsa rispetto alla domanda.
In alcune aree possono essere utilizzate anche acque sotterranee salate o salmastre
o acque dolci in depositi di grande profondità formatisi in epoche geologiche remote (acqua fossile, Tunisia)
Le acque sotterranee e di superficie hanno caratteristiche notevolmente differenti.
L'acqua di falda
in genere è migliore dell'acqua di superficie per il consumo umano.
Può in qualche caso avere un contenuto notevole di sali indesiderati, perché scioglie dei minerali dalle formazioni rocciose con le quali viene a contatto,
La maggior parte dei microorganismi presenti originariamente nell'acqua sono gradualmente filtrati via durante il suo passaggio attraverso le formazioni minerali.
Le acque superficiali,
durante il loro corso verso l'oceano, sciolgono o sospendono molte sostanze.
L'acqua superficiale in un lago o in un bacino può contenere gli elementi nutritivi essenziali allo sviluppo delle alghee sviluppare una massiccia crescita di queste.
Acque superficiali con un'alta concentrazione di materiale organico biodegradabile in genere contengono abbondanti popolazioni di batteri, che di esso si nutrono.
Esempio di Bilancio dell'acqua
Stime effettuate per gli Stati Uniti continentali:
Precipitazione media: ca. 1.48x1013 L giorno-1 76 cm anno-1
Traspirazione o evaporazione: ca. 1.02x1013 L giorno-1 53 cm anno-1
Restano teoricamente: ca. 4.4x1012 L giorno-1 23 cm anno-1.
Consumi attuali: ca. 1.6x1012 L giorno-1 8 cm anno-1.
Consumo all'inizio del 1900: ca. 1.66x1011 L giorno-1 0.85 cm anno-1
Var.: + 10 volte.
Consumo pro capite: 1900 ca. 40 L persona-1 giorno-1
giorni nostri ca. 600 L persona-1 giorno-1 Var.: + 15 volte.
Distribuzione consumi attuali:
usi industriali 46 %
usi agricoli 46 %
usi civili 8%
Italia (città di Torino) 1952 239 L persona-1 giorno-1
Media Italia 2003 200 L persona-1 giorno-1
Consumo nelle città (L abitante-1 giorno-1)
(Media Italia: 200 L abitante-1 giorno-1)
Le più sprecone |
Le più econome |
||
|
|
|
|
Latina |
692.14 |
Ascoli Piceno |
127.30 |
Frosinone |
641.21 |
Palermo |
138.66 |
Vibo Valentia |
469.67 |
Forlì |
154.18 |
Venezia |
413.54 |
Taranto |
161.28 |
Utilizzi dell’acqua (milioni di m3 anno-1)
|
Civili |
Industriali |
Irrigui |
Energia |
Totale |
ITALIA |
7 940
19 % |
7 986
19 % |
20 137
48 % |
5 919
15 % |
41 982
100 % |
La distribuzione delle precipitazioni nel tempo e nello spazio non è uniforme.
L’acqua di mare o salmastra può essere desalinizzata con:
Osmosi inversa, elettrodialisi, distillazione solare, distillazione industriale multistadio. Cap. VIII del corso. J. M. Bokris, Environmental chemistry: Cap. 20. The desalination of water
Lo studio dell'acqua si chiama idrologia
Sub-categorie:
Limnologia:
è la disciplina che studia le caratteristiche dell'acqua dolce, comprese le proprietà chimico-fisiche e biologiche.
Oceanografia: la scienza dell'oceano e delle sue caratteristiche chimico-fisiche.
L'acqua ha una serie di proprietà straordinarie che sono indispensabili alla vita, molte delle quali sono dovute alla possibilità della molecola d'acqua di formare legami idrogeno.
Queste caratteristiche sono riassunte nella tabella 2.1.
Tabella 2.1. Importanti proprietà dell'acqua.
Proprietà |
Effetti e importanza nell’ambiente fisico e biologico |
|
|
Eccellente solvente |
Trasporta nutrienti e prodotti di rifiuto rendendo possibili i processi biologici |
Ha la più alta costante dielettrica di ogni altro comune liquido |
Permette la solubilizzazione e la ionizzazione delle sostanze polari in soluzione |
Ha la più alta tensione superficiale di ogni altro liquido |
Importante in fisiologia: governa i fenomeni di capillarità, la formazione delle gocce e l’interazione con le superfici |
E' trasparente alla luce nel visibile e nell’ UV a maggiore lunghezza d'onda |
E' incolore e permette alla luce necessaria alla fotosintesi di raggiungere considerevoli profondità nei corpi d'acqua |
Come liquido ha la massima densità a 4 °C |
Il ghiaccio galleggia; la circolazione verticale è limitata in corpi d'acqua stratificati |
Ha un notevolmente alto calore di vaporizzazione |
Calore di vaporizzazione: 585 cal g-1, 2.4 kj g-1 (10 kcal mole-1, 44 kj mole-1 a 20°C). Regola il passaggio del calore e di molecole d'acqua tra l'atmosfera e i corpi d'acqua. Un corpo d'acqua funziona da volano termico per una regione. |
Ha il più alto calore di fusione di ogni altro liquido ad eccezione dell'ammoniaca |
Al punto di congelamento dell'acqua la temperatura è stabilizzata. Sono pochi i grossi bacini che solidificano completamente, perché il ghiaccio in superficie protegge l'acqua sottostante
|
Ha la più alta capacità termica di ogni altro liquido ad eccezione dell'ammoniaca |
Capacità termica: 1 cal (4.184 j) g-1 grado-1.. Serve tanto calore per cambiare la temperatura dell'acqua. Protegge gli organismi da grossi sbalzi di temperatura. Stabilizza la temperatura di regioni geografiche. |
La struttura molecolare dell’acqua (H2O)
La struttura molecolare dell’acqua è mostrata nella seguente Figura.
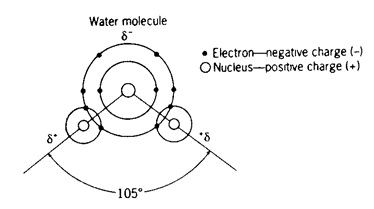
Ciascun atomo di idrogeno è chimicamente legato all’atomo di ossigeno.
d-
La maggiore elettronegatività dell’atomo di ossigeno e i suoi due doppietti di elettroni non condivisi fanno in modo che la parte della molecola occupata dall’ossigeno possieda una piccola carica negativa.
d+
La parte di molecola occupata dagli idrogeni ha una piccola carica positiva.
Dal momento che esiste questa diseguale distribuzione della carica, questi legami (O-H) vengono chiamati legami covalenti polari.
Poiché queste cariche sono significativamente più deboli di quelle associate agli ioni e ai legami ionici, sono rappresentate dai simboli d- e d+.
104.5° vs 109.5°
L’atomo di ossigeno possiede in totale 4 doppietti di elettroni, facendo in modo che la molecola di acqua abbia una geometria tetraedrica.
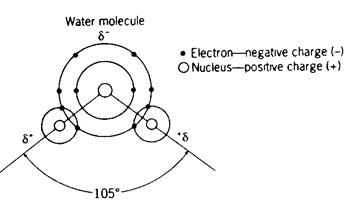 In una geometria tetraedrica ideale gli angoli di legame sono di 109.5°.
In una geometria tetraedrica ideale gli angoli di legame sono di 109.5°.
Gli angoli di legame nell’acqua sono leggermente più piccoli (104.5°), dal momento che i doppietti di elettroni non condivisi occupano un volume maggiore dei doppietti di legame.
Il legame idrogeno nell’acqua
La forza che nel ghiaccio influenza l’orientazione delle molecole d’acqua si chiama legame idrogeno.
Il legame idrogeno è una forza intermolecolare relativamente debole.
Infatti:
Legame idrogeno H--- O --- H: 4.78 Kcal, 20 KJ
Legame covalente: O-H 110 Kcal, 459 KJ
E’ dovuto alla attrazione elettrostatica esercitata dalla parte di una molecola caricata negativamente verso la parte caricata positivamente di una molecola vicina.
Come mostrato in Figura, questa attrazione fa in modo che i doppietti non condivisi nelle parti delle molecole contenenti ossigeno si orientino verso gli atomi di idrogeno delle molecole vicine.
Fonte: http://www.liceodavinci.tv/corsi_universitari/pavoni%20Chim-Amb.docx
Sito web da visitare: http://www.liceodavinci.tv
Autore del testo: Pavoni
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve