

I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
Guida allo studio dell’ibridazione
Il guscio di valenza del carbonio nello stato fondamentale (energeticamente più stabile) contiene due elettroni nell’orbitale 2s, sferico, e un elettrone ciascuno nei due orbitali 2px e 2py, aventi forma “bilobata”, disposti a 90 gradi l’uno rispetto all’altro (“8” e “¥”). Inoltre c’è anche un altro orbitale perpendicolare agli altri due, il 2pz, che però è inutilizzato. Gli elettroni degli orbitali p sono leggermente meno legati dei due elettroni 2s.
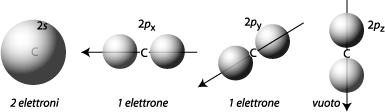
In queste condizioni il carbonio ha dunque solo due elettroni spaiati e con H· potrebbe formarsi al massimo il composto :CH2, che non raggiungerebbe neppure l’ottetto.
Problema 1. Disegnare la struttura che CH2 dovrebbe avere secondo la teoria VSEPR.
In realtà il carbonio trova sempre una soluzione per formare un maggior numero di legami e raggiungere l’ottetto. Per farlo “promuove” un elettrone dal 2s al 2pz. L’energia necessaria per questo piccolo “salto in alto” è poi abbondantemente recuperata grazie alla formazione di due legami aggiuntivi.
Problema 2. Disegna la configurazione elettronica degli stati fondamentali del boro e dell’azoto con uno schema simile a quello del carbonio a pag 11, e spiega quale dei due atomi ha bisogno di promozione e quale invece non ne ricava alcun vantaggio.
La promozione spiega dunque la tetravalenza del carbonio, ma non si accorda con la tetraedricità. Infatti, essendo gli orbitali 2px, 2py e 2pz ortogonali (a 90°) tra loro, essi dovrebbero legare tre atomi di idrogeno ad angoli di 90° (Fig. 1 a).
Fig. 1 a |
Fig 1 b |
Inoltre, essendo i due lobi degli p identici, gli elettroni sarebbero per metà del tempo posti al di là delle regioni comprese tra i noccioli di C ed H, rimanendo sotto-utilizzati nella formazione del legame covalente (ricordiamo che il legame covalente si basa sull’attrazione tra una coppia di elettroni e i due noccioli positivi tra cui è condivisa).
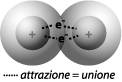
Il quarto atomo di idrogeno dovrebbe invece sovrapporsi alla sfera dell’orbitale 2s, rimanendo il più lontano possibile dagli altri tre H (a 125° 16’, Fig. 1 b). Questo legame, inoltre, dovrebbe essere più forte degli altri tre, poiché l’orbitale s è più legato al nucleo degli orbitali p.
La struttura del metano, CH4, con quattro idrogeni uniti in modo perfettamente identico al carbonio, ad angoli uguali di 109° 28’, e distanze identiche di 110 pm, smentisce il modello basato sugli orbitali atomici 2s, 2px, 2py, 2pz, con tre angoli H-C-H di 90° e uno di 125° 16’.
Problema 3. Scrivi il valore degli angoli H-C-C previsti dalla teoria VSEPR nei seguenti tre casi: a) H2C=CH2; b) CH3-CH3; c) H-CºC-H.
Una teoria, detta dell’ibridazione, spiega questi fatti ipotizzando che l’atomo utilizzi orbitali atomici diversi, ottenuti dalla “miscelazione” degli orbitali base, e chiamati orbitali ibridi . È bene ricordare subito che gli orbitali ibridi non sono una realtà, ma solo un modo complesso utilizzato dalla meccanica quantistica per calcolare la nuova disposizione degli elettroni di valenza, una volta che l’atomo si sia legato ad altri atomi. La teoria VSEPR ci dice in modo molto più rapido, e senza calcoli, che i domini elettronici (gruppi di 2, 4 o 6 elettroni), necessari a legare gli atomi, scorrono sulla sfera di valenza, fino a disporsi al maggior angolo l’uno dall’altro; e mentre lo fanno gli orbitali s e p si rimescolano perdendo la loro identità. Secondo la teoria dell’ibridazione, se partiamo dagli orbitali 2s, 2px, 2py, 2pz , esistono tre diversi casi limite .
Ibridazione sp3
Dopo la “promozione” di un elettrone da 2s a 2pz, tutti e quattro gli orbitali 2s, 2px, 2py, 2pz “si mescolano” e si formano quattro orbitali identici, chiamati sp3.
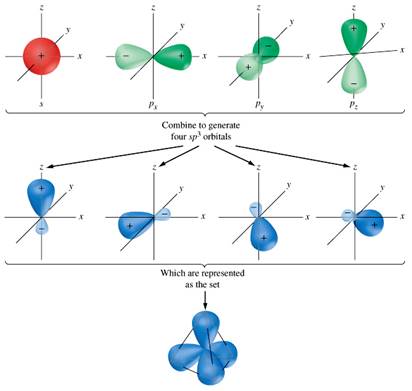
Problema 4. In quali orbitali sono distribuiti gli elettroni di valenza dell’azoto in :NH3?
Ibridazione sp2
In questo caso ci sono tre domini di elettroni da utilizzare per formare legami con l’atomo centrale, quindi sono mescolati solo tre orbitali 2s, 2px, 2py; per formare tre orbitali ibridi sp2 orientati a 120° l’uno dall’altro sul piano x-y. Il 2pz, perpendicolare ai tre ibridi, rimane escluso da questa operazione, e sarà utilizzabile per formare un ulteriore legame con uno dei tre gruppi.
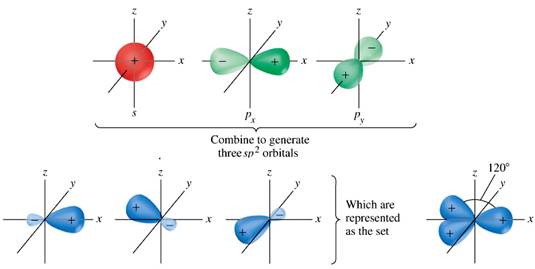
Gli elettroni negli orbitali sp2, avendo 1/3 di carattere s, sono più legati al nucleo degli elettroni sp3; per la stessa ragione i legami da essi formati sono più corti e più forti.
Ibridazione sp1 (o sp)
Quando all’atomo centrale si legano solo due atomi, e i domini di elettroni si dispongono a 180°, l’atomo miscela solo gli orbitali 2s e 2px, generando i due orbitali ibridi sp2, orientati in direzioni opposte. Gli orbitali 2py e 2pz esclusi dall’ibridazione, perpendicolari sia tra loro che alla direzione degli ibridi, rimangono a disposizione per formare due doppi legami o un triplo legame con gli atomi legati.
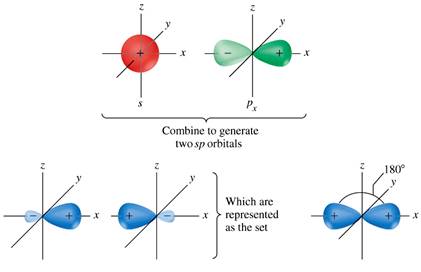
Avendo un 50% di carattere s, gli ibridi sp sono più corti degli sp2, legano maggiormente gli elettroni e formano legami più corti e forti.
Problema 5. Quale ibrido del carbonio ha maggior elettronegatività?
Problema 6. Associa le seguenti lunghezze di legame C-H: 107,6 pm; 106,1 pm e 109,5 ai rispettivi composti CH4; C2H4; C2H2.
Formazione di legami con gli orbitali sp³
Un atomo forma quattro ibridi sp³ quando deve ospitare intorno a sé quattro domini di elettroni. Esistono diverse situazioni interessanti: a) quattro legami covalenti singoli; b) tre legami singoli e una coppia elettronica solitaria, detta anche doppietto libero o lone pair (lp); c) due legami singoli e due doppietti. Di seguito sono disegnati i diversi casi.
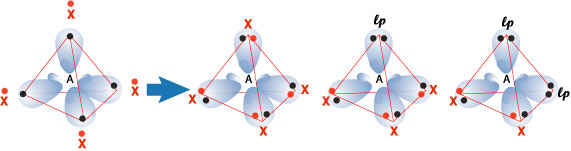
Problema 7. Associa a ciascuna diversa struttura le molecole a) BH4¯; b) H3O+; c) H2O; d) NH4+; e) CH3¯; f) NH2¯; g) NH3; h) CH2Cl2.
Formazione di legami con gli orbitali sp²
Un atomo forma tre ibridi sp² quando deve ospitare intorno a sé tre domini di elettroni. Sono richiesti almeno sei elettroni condivisi, ma poiché in genere si raggiunge l’ottetto, si forma solitamente un ulteriore legame (detto p per la forma particolare della zona di sovrapposizione sopra e sotto la linea di unione dei i due atomi A e Y)) che va a raddoppiare uno dei tre formati per mezzo degli ibridi sp². I casi più interessanti sono i seguenti (solo gli ultimi due raggiungono l’ottetto).
Problema 8. Associa a ciascuna diversa struttura le molecole a) CO3=; b) SO2 ; c) NO2¯; d) C2H4; e) CH3+; f) BF3; g) HN=CH2 ; h) H2C=O.
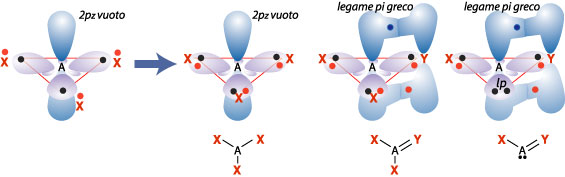
Formazione di legami con gli orbitali sp
Un atomo forma due ibridi sp quando deve ospitare intorno a sé due domini di elettroni. Solo in casi eccezionali non è raggiunto l’ottetto, per esempio quando l’elemento A è un metallo con due soli elettroni di valenza, es.: H3C-Mg-Cl (un composto di Grignard). Quindi prenderemo in considerazione solo i casi in cui si raggiunge l’ottetto. Poiché l’ibridazione sp lascia inutilizzati sia l’orbitale 2py che il 2pz, per raggiungere l’ottetto si formeranno due ulteriori legami p, uno lungo Z, come nel caso sp², e un altro nella direzione Y (sopra e sotto al foglio). Le possibili combinazioni sono:
X=A=X X-AºY XºA:
Problema 9. Associa a ciascuna diversa struttura le molecole a) HCN; b) SCN¯ ; c) HCC:¯; d) N2; e) CO2; f) CO; g) C2H2 ; h) H2C=C=CH2.
Problema 10. Disegna un carbocatione ibrido sp (cioè lineare).
L’ibridazione può essere usata per ricalcolare gli orbitali di legame di tutti gli atomi, non solo del carbonio.
Non esistono solo questi tre casi di ibridazione; gli atomi delle righe sottostanti al 2° periodo possono utilizzare anche gli orbitali d (per esempio sei domini elettronici si dispongono secondo un ottaedro, con ibridazione sp3d2. La parola “casi limite” sta inoltre a indicare che esistono ibridazioni intermedie che variano con gradualità, tra sp1 e sp3, es. sp2,4.
Fonte: http://www.divini.net/dc/courses/CO1/document/Che_senso_ha_ci%F2_che_stiamo_imparando/Che_senso_ha_ci%F2_che_stiamo_imparando_3.doc?cidReq=CO1
Sito web da visitare: http://www.divini.net
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve