

I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
L’esperimento di Rutherford
Anche se all’inizio gli elettroni vennero associati unicamente alle correnti elettriche, nel giro di pochi anni fu dimostrato, attraverso le misure di radioattività, che essi dovevano essere parte integrante degli atomi. Emerse di conseguenza l’ipotesi che all’interno dell’atomo dovesse esistere una corrispondente carica positiva. Thomson stesso suggerì l’idea che l’atomo fosse costituito da una sfera di carica positiva, in cui gli elettroni erano disseminati «come l’uvetta nel panettone».
Lo scienziato neozelandese Ernest Rutherford e i suoi collaboratori Geiger e Marsden, dopo aver determinato la natura delle radiazioni α (atomi di elio privi di due elettroni), le utilizzarono per bombardare gli atomi d’oro di una sottilissima lamina, dello spessore di 0,01 mm (▶figura 2.6). Dopo l’urto con gli atomi di oro, le particelle α, circa 10 000 volte più pesanti di un elettrone, ma del tutto invisibili all’occhio umano, venivano raccolte da un apposito schermo capace di evidenziare la loro presenza. I risultati dell’esperimento furono i seguenti:
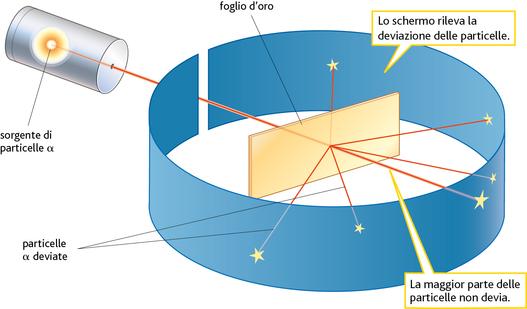
figura 2.6 L’esperimento di Rutherford.
Grazie alla misura degli angoli di deflessione e all’applicazione della legge di Coulomb, Rutherford propose per l’atomo il seguente modello:
A differenza del modello proposto da Thomson, l’atomo di Rutherford è in grado di spiegare i dati raccolti sperimentalmente (▶figura 2.7). Infatti, le poche particelle α che arrivano molto vicino al nucleo sono respinte violentemente dalla sua carica positiva, come se fosse un muro impenetrabile, e tornano indietro. Quasi tutte le altre sono invece soltanto deflesse, o proseguono indisturbate, perché lontano dal nucleo la forza repulsiva è minore ed è attenuata dalla presenza degli elettroni.
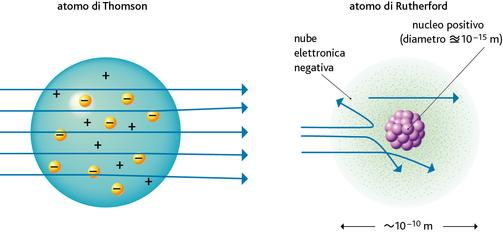
figura 2.7I due modelli di Thomson e Rutherford a confronto: se l’atomo non possedesse un nucleo, le particelle α non sarebbero deviate rispetto alla direzione iniziale.
Anche se il modello atomico «planetario» è stato abbandonato poco tempo dopo, la struttura nucleare dell’atomo è tutt’oggi valida. Il nucleo è la parte più significativa dell’atomo, perché atomi di elementi diversi hanno diversa struttura del nucleo.
Fonte: http://cursa.ihmc.us/rid=1ND9VN1NY-17T2NXD-20G6/rutherford.docx
Sito web da visitare: http://cursa.ihmc.us/
Autore del testo: indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve