I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
PRIMO PRINCIPIO DELLA TERMODINAMICA
Def. 1. Chiamo sistema una definita quantità di materia oppure una definita porzione di spazio che si intende studiare. Il sistema è delimitato da superfici (o pareti o confini): tutto ciò che è esterno al sistema prende il nome di ambiente.
Oss 1. La superficie che definisce il sistema può essere una superficie reale che contorna il sistema, o semplicemente una superficie ideale, tracciata di volta in volta secondo criteri di logica e comodità. Ad esempio, in uno scooter se sono interessato a studiare il processo di combustione della benzina potrei considerare come sistema la miscela aria-benzina e come ambiente il cilindro, il pistone il condotto di scarico e l’aria esterna; invece, se voglio analizzare il funzionamento dello scooter nella sua globalità posso considerare tutti i suoi numerosi pezzi (motore, telaio, ruote..) come sistema e come ambiente tutto ciò che si trova al di fuori dello scooter.
Def. 2 Un sistema per il quale siano possibili scambi di energia, ma non di massa con l’esterno, viene definito sistema chiuso. Sono esempi di sistemi chiusi i circuiti di riscaldamento domestico e i recipienti ermeticamente sigillati. Per sistema aperto si intende un sistema per il quale sono resi possibili gli scambi sia di energia che di massa con l’esterno. Ne è un esempio una pentola, aperta contenete del liquido in ebollizione.
La termodinamica studia le leggi con cui i sistemi scambiano (cioè cedono o ricevono) energia con l’ambiente.Questi scambi di energia avvengono sotto forma di calore e di lavoro in modo tale da rispettare rispettano la seguente relazione nota come Primo principio della termodinamica:
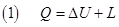
dove U è l’energia interna di un sistema intesa come la somma di tutte le energie delle molecole che costituiscono il sistema e DU è la sua variazione. Avremo, ad esempio, per un gas monoatomico:

Adottando la seguente convenzione sui segni del calore e del lavoro:
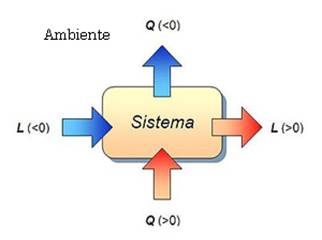
la relazione (1) può dare atto a diverse interpretazione tra le quali:
a) Mentre abbiamo visto che tutto il lavoro può essere convertito in lavoro (pensiamo alle mani strofinate) non è invece possibile l’inverso, vale a dire che quando fornisco calore Q ad un sistema, una parte viene convertita in lavoro L mentre la rimanente viene immagazzinata dal sistema sotto forma di variazione di energia interna DU.
b) Ricavando DU dalla (1) otteniamo 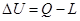 dalla quale concludiamo che in meccanica esistono due modi per aumentare l’energia interna di un sistema: compiere un lavoro su di esso (L<0) mediante una forza oppure somministrando a esso calore (Q>0), ponendolo per esempio a contatto con un corpo a temperatura maggiore. In entrambi i casi nel corpo fluisce una quantità di energia che va ad aumentare l’energia totale delle molecole che lo costituiscono.
dalla quale concludiamo che in meccanica esistono due modi per aumentare l’energia interna di un sistema: compiere un lavoro su di esso (L<0) mediante una forza oppure somministrando a esso calore (Q>0), ponendolo per esempio a contatto con un corpo a temperatura maggiore. In entrambi i casi nel corpo fluisce una quantità di energia che va ad aumentare l’energia totale delle molecole che lo costituiscono.
c) La (1) permette di capire perché, a parità di massa e di aumento di temperatura non è la stessa cosa scaldare un gas a volume costante o a pressione costante. Infatti nel primo caso tutto il calore va ad incrementare l’energia interna del gas; nel secondo, una parte del calore serve a far compiere al gas un lavoro esterno e perciò ne occorre di più.
d) Il sistema più semplice che verifica la (1) è un gas contenuto in un cilindro chiuso.
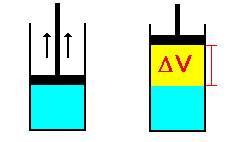
Per effetto del calore fornito il gas si espande a pressione costante e compie un lavoro sollevando il pistone dato da: 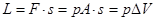 . Tuttavia, non tutto il calore si è trasforma in lavoro poiché una parte, la variazione dell’energia interna DU, è stata assorbita dal gas, dal cilindro e dallo stantuffo i quali si scaldano.
. Tuttavia, non tutto il calore si è trasforma in lavoro poiché una parte, la variazione dell’energia interna DU, è stata assorbita dal gas, dal cilindro e dallo stantuffo i quali si scaldano.
Le pareti del cilindro che si lasciano attraversare dal calore sono chiamate pareti diatermiche, mentre delle pareti perfettamente isolanti, che impedirebbero qualunque scambio di calore tra il sistema e il suo ambiente, sono chiamate pareti adiabatiche e le corrispondenti trasformazioni del gas vengono dette trasformazioni adiabatiche. Da notare che un gas può eseguire delle trasformazioni adiabatiche anche quando le pareti non sono tali basta che queste trasformazioni avvengano molto velocemente; in tal caso infatti il gas non fa in tempo a scambiare calore con l’esterno.
E’ evidente che:
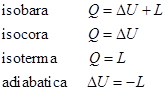
Fonte: http://www.fisicaweb.org/doc/termodinamica/Termod_2012.doc
Sito web da visitare: http://www.fisicaweb.org/doc/termodinamica/Termod_2012.doc
Autore del testo: non indicato nel documento di origine
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve