I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
L’Oncologia è la branca della medicina che si occupa dei tumori.
Il tumore, termine usato in origine per indicare qualsiasi processo che si manifestasse con un rigonfiamento o tumefazione di una parte del corpo, è oggi sinonimo di neoplasia, cioè neoformazione di tessuto che si origina in seguito ad un processo anormale di differenziazione e riproduzione cellulare. L’accrescimento è autonomo, progressivo e senza finalità. Le cellule che costituiscono il tumore possono differire più o meno nettamente da quelle del tessuto di origine.
In relazione al loro comportamento e alla loro natura, i tumori vengono classificati in benigni e maligni.
Nei primi, nonostante la riproduzione cellulare sia aumentata, le cellule mantengono l'aspetto e la funzionalità molto simile a quelle di origine, la crescita è lenta e il tumore è circondato da una capsula. Una volta asportato chirurgicamente, questo tumore si riforma raramente.
Il tumore maligno, o neoplasia o impropriamente cancro, è caratterizzato da atipia cellulare più o meno marcata con aumento volumetrico sia della cellula in toto sia del nucleo, spesso è presente poliploidismo con mitosi anomale. Ciò caratterizza una crescita veloce, a volte tumultuosa, illimitata, con invasione e distruzione dei tessuti circostanti. Quando l’invasione raggiunge i vasi ematici e linfatici, cellule tumorali, attraverso il sangue e la linfa possono pervenire in organi lontani e generare nuove formazioni tumorali, le metastasi.
CARATTERISTICA TUMORI BENIGNI TUMORI MALIGNI
Tipo di crescita incapsulata infiltrativa
Ritmo di crescita lento rapido
Costanza di crescita stazionario o regredisce progressivo
Vascolarizzazione presente periferica
Ulcerazioni occasionali frequenti
Sintomi occasionali frequenti
Metastasi assenti frequenti
Recidiva (dopo chirurgia) rara frequenti
Fattori di crescita molti e complessi pochi e semplici
Capacità di coesione buona* scadente**
Inibizione da contatto elevata* assente**
Mobilità scarsa notevole
Possibilità di trapianto scarsa elevata
*Le cellule crescono bene sul fondo di una capsula di Petri e cessano di crescere quando toccano i bordi.
**Le cellule crescono bene sia sul fondo che in sospensione e continuano a crescere dopo aver toccato i bordi della capsula di Petri.
Per quale motivo una o più cellule normali acquistano improvvisamente caratteristiche di malignità? E' questo uno dei problemi che da anni impegna scienziati di tutto il mondo perchè solo in questo modo vi può essere la possibilità di vincere il cancro.
Negli organismi pluricellulari alcuni tessuti, quali quelli epiteliali come la pelle, le pareti gastrointestinali e dell'apparato respiratorio, si rinnovano a partire da cellule madri che si dividono per mitosi, mentre le cellule più vecchie vengono eliminate, in modo che il numero complessivo rimanga costante.
La morte delle cellule "vecchie" avviene attraverso due processi diversi tra loro:
L’interesse degli studiosi si è concentrato sulla apoptosi nel tentativo di scoprire il perché della proliferazione cellulare incontrollata e quindi dell’origine di un tumore.
Il processo dell’apoptosi o morte cellulare programmata è stata identificata negli anni 70 ma l'interesse è esploso solo negli anni novanta, insieme all'idea del prolungamento della vita e dell'eliminazione selettiva di alcune popolazioni cellulari responsabili dell'insorgenza di alcune patologie.
Le recenti scoperte nel campo della biologia molecolare, hanno permesso di progredire nella tipizzazione del genoma umano decifrando molte delle basi chimiche del DNA e quindi dei geni che lo compongono.
La conoscenza dei geni responsabili della apoptosi, ossia della morte cellulare programmata, e i meccanismi con cui esplicano la loro funzione può rappresentare il primo passo per la comprensione dei processi che portano alla trasformazione di una cellula normale in cellula neoplastica.
Fino ad oggi sono stati scoperti alcuni geni che, se alterati, possono portare alla proliferazione cellulare incontrollata.
Ad esempio il gene denominato p53, ferma l'accrescimento e la divisione cellulare nel caso in cui vengano rilevati dei danni al DNA. Questi devono essere riparati, altrimenti la cellula viene indirizzata verso la morte.
Il gene denominato c-myc, induce la moltiplicazione cellulare se sono presenti proteine specifiche denominate fattori di sopravvivenza; in assenza di questi, invece, innesca l'apoptosi.
L'apoptosi riveste, in condizioni fìsiologiche, un ruolo fondamentale nello sviluppo embrionale, concorrendo alla definizione delle strutture anatomiche: per es., essa è responsabile dell'eliminazione dei tessuti interdigitali durante lo sviluppo fetale degli arti, o di quelle parti del tessuto nervoso che non hanno stabilito connessioni sinaptiche e che quindi non potrebbero assolvere alle loro funzioni. Un altro compito assolto dall'apoptosi è di tipo "altruista": in una cellula sottoposta a stress ambientali talmente forti da non poter reagire e difendersi mediante la sintesi delle proteine da stress o da shock termico (fattori di sopravvivenza), viene attivato il programma di morte. Questo tipo di controllo è estremamente vantaggioso per le cellule che la circondano e per l'intero organismo: l'apoptosi non consente il rilascio di sostanze endocellulari nell'ambiente esterno, come avviene nella necrosi, ma vengono degradate a molecole semplici che possono essere riutilizzate dalle altre cellule per il loro metabolismo e non si genera così nessun evento infiammatorio.
È nota poi un'intera famiglia di geni inibitori dell'apoptosi, la cui attività si riscontra in numerose patologie tumorali. L'attività errata di questi geni sottrae la cellula al suo destino e ne permette la crescita e le successive divisioni, causando l'insorgenza di tumori. Al contrario, alcune patologie sono legate a una morte cellulare precoce e inopportuna: per esempio, in pazienti affetti da A.I.D.S. è stato dimostrato che la mancanza di risposta immunitaria è dovuta alla morte di una particolare famiglia di linfociti, le cellule CD-4; questo fenomeno è causato dal fatto che le cellule infette sono geneticamente modificate e, quando vengono stimolate invece di moltiplicarsi per dare una risposta immunitaria adeguata, reagiscono innescando il processo dell'apoptosi.
Anche alcune malattie neurodegenerative, quale il morbo di Alzheimer o il morbo di Parkinson, sono dovute alla morte delle cellule nervose e probabilmente imputabile ad una apoptosi anomala.
Conoscendo i meccanismi che sono alla base del processo della morte cellulare, sembra plausibile studiare delle terapie che, influenzando negativamente o positivamente l'attivazione dell'apoptosi, possano risultare efficaci.
Nel caso di alcuni tumori, per esempio, sono stati condotti degli esperimenti in cui, bloccando i geni responsabili della resistenza alla morte, è stata innescato l'andamento suicida delle cellule tumorali. Una scoperta di particolare rilievo ha messo in luce il fatto che molti agenti patogeni, soprattutto di tipo virale, influenzano la cellula ospite con sistemi antiapoptotici. Ciò è chiaramente legato al fatto che un qualsiasi virus indirizza l'attività cellulare verso la sintesi dei propri componenti, per la produzione di nuove particelle virali: se la cellula morisse impedirebbe la riproduzione, a svantaggio dell'organismo patogeno.
Se il corretto comportamento di una cellula risiede nel suo DNA, fattori esterni possono alterare il suo equilibrio inducendo trasformazioni neoplastiche.
Attualmente si conoscono le relazioni esistenti tra alcuni prodotti chimici e l'induzione del cancro, come l'asbesto, il benzene, la benzidina, la fuliggine, il catrame, il cloruro di vinile, il plutonio. Inoltre vi è relazione tra sostanze naturali e cancro come l'aflatossina prodotta dal fungo Aspergillus Flavus che contamina noci e cereali immagazzinati in ambienti umidi.
Ma anche agenti fisici, come le radiazioni elettromagnetiche, sono cancerogeni; ad esempio i Raggi X e soprattutto le sostanze radioattive come purtroppo hanno dimostrato le passate e recenti esplosioni nucleari. Anche l'esposizione prolungata ai raggi ultravioletti comporta rischi per la possibile insorgenza di tumori della cute specie nelle persone a carnagione chiara.
Vi sono inoltre correlazioni tra diete e tumori come si evidenzia nello studio comparato di popolazioni con cultura e stili di vita differenti.
Oltre a questi agenti e fattori esterni o estrinseci, vi sono dei fattori intrinseci che possono concatenarsi con i precedenti, ad esempio il sesso, l'età, la razza, ecc.
Si può riscontrare poi per pochi tumori una significativa incidenza familiare come nel cancro della mammella, dell'utero, del retto e nel retinoblastoma dell'occhio.
Infine vi è una correlazione tra alcuni tumori e anomalie genetiche con cromosomi anomali, tipico tra tutti il rapporto tra leucemia mieloide cronica e anomalia cromosomica detta del cromosoma Philadelphia (Ph1).
Anche le infezioni virali hanno la possibilità, modificando il DNA umano, di indurre una proliferazione cellulare anomala, soprattutto se si tratta di virus “lenti” che si riproducono per via vegetativa. Infatti il virus penetra nelle cellule, si inserisce nel DNA umano e, riproducendosi, genera cellule figlie con contenuto genetico virale, per cui non si ha la morte della cellula ma la formazione di cellule apparentemente normali con contenuto genetico abnorme (cellula infettata quiescente).
Le cellule infettate dal virus possono riprodursi anche per generazioni senza dare segni di anomalie, se però vengono sollecitate, vi è la possibilità di una degenerazione tumorale.
A causa di questa molteplicità di aspetti e comportamenti ogni tumore deve essere studiato e curato caso per caso, ma per avere un punto di riferimento è necessario disporre di modelli sperimentali che, opportunamente adattati, ci permettano di conoscere il comportamento delle cellule neoplastiche e quindi aumentare le possibilità di successo nella cura di questa malattia.
Il tumore che viene normalmente preso come modello è il cancro della mammella, perchè:
1) la crescita del tumore è facilmente rilevabile nel tempo;
2) il numero elevato di casi permette di avere una distribuzione statistica significativa;
3) è un tipo di tumore noto fin dall'antichità e si hanno descrizioni dettagliate e attendibili in comunicazioni mediche che risalgono al secolo scorso.
Sulla base degli studi effettuati sulla mammella si può esemplificare la crescita del tumore con il grafico seguente:
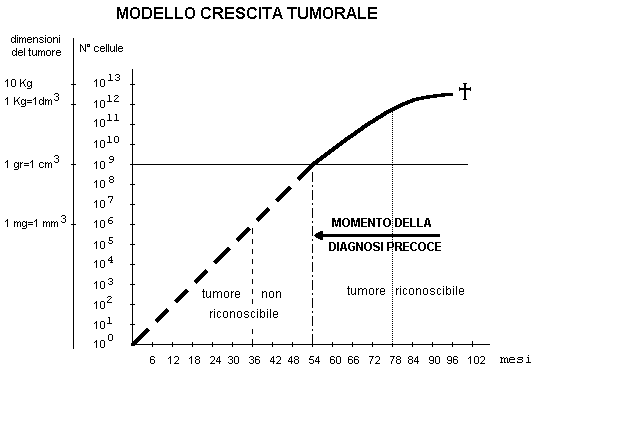
METASTASI
Si è già accennato che una delle caratteristiche del tumore maligno è di dare metastasi.
Infatti man mano che le cellule aumentano di numero, necessitano di una maggior quantità di sostanze nutritizie trasportate dal sangue. Per tale motivo, nelle immediate vicinanze di una massa tumorale, si osserva una proliferazione di nuovi vasi sanguigni ed essendo le cellule neoplastiche poco legate tra di loro, possono entrare nella corrente ematica e venire trasportate in organi lontani dove possono fermarsi e, trovando le condizioni adatte, moltiplicarsi generando nuove formazioni tumorali cioè le metastasi.
Anche se teoricamente ogni organo può essere metastatizzato, per motivi legati alla struttura e alla funzionalità, le sedi che più frequentemente vengono invase dalle cellule tumorali sono polmoni, fegato, ossa, cervello, cute.
I meccanismi, mediante i quali i tumori primitivi invadono localmente i tessuti e diffondono in sedi lontane prevedono l'intervento di fattori che:
La conoscenza di questi meccanismi potrebbe sviluppare la scoperta di nuovi farmaci, destinati ad essere impiegati a livello clinico.
Per originare metastasi, le cellule neoplastiche devono essere in grado di diffondere nei tessuti circostanti, penetrare in circolo e migrare in altre sedi nelle quali, arrestandosi, possono proliferare. Nonostante un gran numero di cellule neoplastiche possa abbandonare il tumore primitivo e passare in circolo, soltanto lo 0,01% di queste cellule riesce a sopravvivere e a dare origine a tumori secondari. Tuttavia, dal momento che anche le cellule metastatiche hanno la capacità di moltiplicarsi, il carico di cellule tumorali del paziente può aumentare in maniera esponenziale. In effetti, le cellule neoplastiche maligne tendono a diffondere nell'intero organismo e metastatizzare in organi importanti, quali i polmoni, il cervello, il fegato ed il midollo osseo.
La capacità di metastatizzazione dipende in parte da un processo angiogenetico, attraverso il quale i tumori inducono la formazione di nuovi vasi, iniziando con lo sviluppo di gemmazioni capillari e progredendo fino alla formazione di una rete vascolare. I vasi neoformati situati nell'interno ed alla periferia della massa tumorale, apportano le sostanze nutritive necessarie per la crescita del tumore oltre che costituire una via di accesso al circolo per la colonizzazione. A causa di uno scarso sviluppo della membrana basale, questi vasi presentano una parete sottile e risultano facilmente permeabili.
Sia i tessuti normali che quelli tumorali producono vari fattori angiogeni, comprendenti fattori di crescita di fibroblasti, di fattori trasformanti ed di angiogenine. Molti di questi fattori stimolano la migrazione delle cellule endoteliali in direzione del tumore ed inducono spesso un aumento della motilità delle cellule tumorali. Tali fattori possono costituire un nuovo bersaglio per un intervento terapeutico.
Per l'invasione e la metastatizzazione, le cellule tumorali devono superare le membrane basali epiteliali ed endoteliali, costituite da una fitta rete di diverse molecole di proteine e carboidrati.
L'invasione avviene in tre momenti principali, rappresentati:
A questo punto le cellule invasive possono proliferare per dare origine a colonie metastatiche.
Aspetti molecolari della metastatizzazione
La dimostrazione che l'oncogenesi e la metastatizzazione sono sottoposte ad un controllo genetico ha creato un punto importante per le ricerche di laboratorio. Ad esempio l'oncogéne ras, utilizzato per lo studio della metastatizzazione, era stato originariamente riconosciuto come oncogéne per la sua capacità di indurre la trasformazione neoplastica maligna delle cellule normali. Anche altri oncogéni si sono dimostrati in grado di indurre lo sviluppo del fenotipo maligno o metastatico in alcune cellule. Alcuni esempi di questi oncogéni sono offerti dagli oncogéni v-mos, v-raf, v-src, v-fes e v-fms, che controllano le funzioni chinasiche.
È stato inoltre caratterizzato un gene soppressore della metastatizzazione, indicato come NM23. Nelle cellule tumorali ad elevata tendenza metastatizzante, l'espressione di questo gene risulta ridotta. La sua assenza nei campioni di tessuto carcinomatoso si accompagna ad una metastatizzazione progressiva. Un'importante nuova metodica dell'oncologia molecolare è rappresentata dalla "mappatura" degli oncogéni e dei componenti chiave della progressione e della metastatizzazione delle neoplasie maligne.
La definizione di nuovi metodi di cura delle neoplasie maligne costituisce una meta importante della ricerca di base. La migliore conoscenza dei meccanismi biochimici e genetici che presiedono alla crescita, alla diffusione ed alla metastatizzazione delle cellule tumorali può portare alla produzione di nuovi farmaci in grado di inibire la proliferazione, la migrazione e l'insediamento delle cellule tumorali.
Oltre che con il sangue i tumori possono metastatizzare attraverso i vasi linfatici. Questi trasportano la linfa che tra le sue funzioni ha il compito di difendere il nostro organismo dalle sostanze estranee che possono invaderlo e le cellule neoplastiche sono considerate estranee. Tutti questi vasi si riuniscono in strutture solide di aspetto ghiandolare chiamate linfonodi. Questi sono distribuiti in tutto il corpo, in particolare al collo, alle ascelle, agli inguini ma anche nelle vicinanze di tutti gli organi interni (polmoni, fegato, stomaco, ecc.).
Quando le cellule tumorali, attraverso la linfa, pervengono ai linfonodi, viene aumentata la produzione di linfociti, con lo scopo di distruggere le cellule neoplastiche. A causa della maggior attività dei linfonodi e della presenza delle cellule tumorali, si verifica un aumento sia delle dimensioni che della consistenza di questi.
La presenza di linfonodi aumentati di volume e consistenza è un segno clinico precoce che dimostra la migrazione delle cellule tumorali dalla sede di origine ad organi lontani.
La definizione del tumore nella sua sede primitiva e la identificazione di eventuali metastasi, prende il nome di stadiazione della malattia neoplastica.
Frequentemente sulla base di alcuni disturbi che si prolungano nel tempo senza causa apparente (come febbricola, calo ponderale, modeste perdite ematiche vaginali o dal retto, dolori addominali, escreato striato di sangue, stanchezza molesta, nei che improvvisamente sanguinano o aumentano di diametro, noduli al seno, ecc.) viene posto il sospetto di un probabile tumore. Sarà allora necessario porre una diagnosi di esclusione o di certezza.
A seconda dei disturbi e quindi del presunto organo o apparato interessato, la ricerca dell'eventuale tumore sarà effettuata sia con interventi chirurgici sia utilizzando le tecniche per immagini (Radiologia tradizionale, Ecotomografia, Tomografia Assiale Computerizzata, Risonanza Magnetica) e ovviamente sfruttando al meglio gli esami di laboratorio.
E' importante riuscire ad avere un esame istologico o citologico del presunto tumore, solo così vi sarà la certezza della diagnosi e quindi programmare le cure necessarie.
Oltre alla diagnosi di tumore, per una corretta impostazione della terapia è necessario effettuare la stadiazione. Cioè oltre che l'origine dobbiamo conoscere la sua estensione, sapere quindi se il tumore è ancora localizzato oppure metastatizzato.
Ad esempio un piccolo tumore localizzato al seno può essere curato con la sola asportazione chirurgica del cancro, lasciando pressochè integra la mammella; ma un tumore di grandi dimensioni necessita di una chirurgia estesa, con asportazione di tutta la ghiandola, seguita spesso da cure mediche complementari.
Per semplicità e per avere un punto di riferimento comune, in oncologia, si usa il sistema internazionale "T N M" (T = tumor, N = node linfonodo, M = metastasis) che viene impiegato per descrivere l'estensione anatomica della malattia tumorale valutando tre componenti:
T = estensione del tumore primitivo
N = invasione dei linfonodi loco-regionali
M = metastasi a distanza
Queste sigle sono seguite da numeri che indicano il grado di invasione.
T - TUMORE PRIMITIVO
T0 non vi sono segni di tumore primitivo
TX il tumore non può essere definito (non vi sono segni di esclusione, ma manca la certezza)
Tis carcinoma in situ
T1-4 estensione vera e propria del tumore
N - LINFONODI REGIONALI
N0 non vi sono linfonodi invasi dalla neoplasia
NX non vi sono elementi per valutare la presenza di linfonodi invasi
N1-3 invasione di una o più stazioni dei linfonodi regionali
M - METASTASI A DISTANZA
M0 non vi sono metastasi
MX non vi sono elementi per accertare la presenza di metastasi
M1 presenza di metastasi.
L'invasione dei linfonodi che non siano quelli regionali è considerata metastasi.
Le metastasi possono essere indicate, facoltativamente, con le seguenti abbreviazioni inglesi:
polmonari PUL [monary]
ossee OSS [eous]
epatiche HEP [atic]
cerebrali BRA[in]
linfonodali LYM [phnodes]
midollo osseo MAR [bone MARrow]
pleuriche PLE [ura]
peritoneali PER [itoneum]
cutanee SKI [n]
altre OTH [er]
Per un giudizio prognostico più preciso è utile disporre del GRADING ISTOPATOLOGICO (G), cioè il grado di differenziazione delle cellule tumorali rispetto alle cellule sane.
GX il grading non è definito
G1 tessuto neoplastico ben differenziato (simile al tessuto normale)
G2 tessuto neoplastico moderatamente differenziato
G3 tessuto neoplastico poco differenziato
G4 tessuto neoplastico indifferenziato (molto differente dal tessuto normale)
Quando il sistema TNM viene determinato attraverso l'esame obiettivo, le tecniche radiologiche e gli esami di laboratorio, viene chiamato clinico.
Se il tumore è aggredibile chirurgicamente, dopo la sua asportazione, uno o più parametri del sistema TNM possono essere differenti dal TNM clinico per cui è necessaria una revisione della stadiazione premettendo la lettera “c” o “p” (chirurgico o patologico) alle sigle TNM. Ad esempio, all'esame obiettivo si reperta un nodulo mammario di 3 cm di diametro che l'agoaspirato conferma trattarsi di carcinoma, l'ascella omolaterale è priva di linfonodi, l'Rx torace, la scintigrafia ossea e l'ecografia epatica sono normali: la stadiazione clinica sarà T2 N0 M0. In sede di intervento, il chirurgo asporta un nodulo di 1,8 cm con presenza di 4 linfonodi ascellari invasi da cellule neoplastiche: la neoplasia sarà ristadiata come cT1 N1 M0.
Per semplicità, dopo la definizione del TNM, si possono raggruppare neoplasie che, nonostante presentino indici differenti, da un punto di vista clinico assumono la medesima gravità e che prevedono lo stesso trattamento terapeutico: questi raggruppamenti prendono il nome di stadi della malattia.
Si riporta la classificazione TNM di alcuni tumori e gli stadi per il carcinoma della mammella e del polmone.
(Non è riportato il valore di M per singolo tumore in quanto rispetta la norma generale:M0 non segni di metastasi, MX metastasi non definite, M1 presenza di metastasi )
TX il tumore primitivo non può essere definito
T0 non segni del tumore primitivo
Tis carcinoma in situ
T1 il tumore invade la lamina propria o la sottomucosa
T2 il tumore invade la muscolare propria
T3 il tumore invade l'avventizia
T4 il tumore invade le strutture adiacenti
N1 invasione dei linfonodi regionali
STOMACO
TX il tumore primitivo non può essere definito
T0 non segni del tumore primitivo
Tis carcinoma in situ. Tumore intraepiteliale senza invasione della lamina propria
T1 il tumore invade la lamina propria o la sottomucosa
T2 il tumore invade la muscolare propria (2°) o la sottosierosa (2b)
T3 il tumore infiltra la sierosa (peritoneo)
T4 il tumore invade le strutture adiacenti
N1 invasione dei linfonodi perigastrici entro 3 cm dal tumore
N2 invasione dei linfonodi perigastrici oltre 3 cm dal tumore o lungo le arterie gastrica sinistra, epatica comune, splenica, celiaca
TX il tumore primitivo non può essere definito
T0 non segni del tumore primitivo
Tis carcinoma in situ: intraepiteliale o invasione della lamina propria
T1 il tumore invade la sottomucosa
T2 il tumore invade la muscolare propria
T3 il tumore infiltra la sottosierosa (peritoneo)
T4 il tumore invade le strutture adiacenti e/o perfora il peritoneo
N1 invasione di 1-3 linfonodi pericolici o perirettali
N2 invasione di 4 o più linfonodi pericolici o perirettali
N3 invasione di qualunque linfonodo lungo le arterie ileocoliche, coliche, mesenteriche, rettali
TX il tumore primitivo non può essere definito
T0 non segni di tumore primitivo
Tis carcinoma in situ
T1 tumore limitato al pancreas con dimensione inferiore a 2 cm
T2 tumore al pancreas con dimensione superiore a 2 cm
T3 tumore esteso oltre il pancreas ma senza invasione del tripode celiaco o dell’arteria mesenterica sup.
T4 tumore che infiltra il tripode celiaco o l’arteria mesenterica sup. (tumore non resecabile)
N1 invasione dei linfonodi regionali
TX il tumore non può essere definito; presenza di cellule atipiche nell'escreato o nel lavaggio bronchiale
T0 non segni del tumore primitivo
Tis carcinoma in situ
T1 tumore inferiore a 3 cm senza segni di invasione del bronco principale
T2 tumore superiore a 3 cm o
interessamento del bronco principale a 2 cm o più dalla carena o
invasione della pleura viscerale o
associato ad atelectasia lobare o polmonite ostruttiva lobare
T3 tumore di qualsiasi dimensione che invade: parete toracica, diaframma, pleura mediastinica
T4 tumore di qualsiasi dimensione che invade: mediastino, cuore, grossi vasi, trachea, esofago, vertebre, carena o
versamento pleurico neoplastico
N1 invasione dei linfonodi omolaterali peribronchiali e/o ilari
N2 invasione dei linfonodi omolaterali mediastinici
N3 invasione dei linfonodi controlaterali
TX il tumore non può essere definito
T0 non segni del tumore primitivo
Tis carcinoma in situ
T1 tumore di 2 cm nella dimensione massima
T1a tumore inferiore a 0,5 cm nella dimensione massima
T1b tumore superiore a 0,5 cm ma non più di 1 cm nella dimensione massima
T1c tumore superiore a 1 cm ma inferiore a 2 cm nella dimensione massima
T2 tumore superiore a 2 cm ma inferiore a 5 cm nella dimensione massima
T3 tumore superiore a 5 cm nella dimensione massima
T4 tumore di qualsiasi dimensione con invasione diretta della parete toracica o cute
T4a estensione alla parete toracica con esclusione dei piccoli pettorali
T4b edema o ulcerazione della cute della mammella o noduli satelliti
T4c presenza contemporanea di T4a e T4b
T4d carcinoma infiammatorio
N1 invasione dei linfonodi ascellari omolaterali mobili
N2 invasione dei linfonodi ascellari omolaterali fissi tra loro o ad altre strutture
N3 invasione dei linfonodi della catena mammaria interna omolaterale
PROSTATA (da Schroder 1992)
TX il tumore non può essere definito
T0 non segni del tumore primitivo
T1 tumore clinicamente non evidenziale
T1a scoperto casualmente nel 5% o meno di tessuto resecato (alla TUR)
T1b scoperto casualmente in più del 5% di tessuto resecato (alla TUR)
T1c identificato mediante biopsia su pazienti con PSA elevato
T2 tumore clinicamente apprezzabile limitato alla prostata
T2a coinvolge metà o meno di un lobo
T2b coinvolge più della metà di un lobo
T2c coinvolge entrambi i lobi
T3 infiltra la capsula prostatica
T3a estensione extracapsulare unilaterale
T3b estensione extracapsulare mono-bilaterale
T3c invade le vescichette seminali
T4 tumore fisso o che invade le strutture adiacenti oltre le vescichette seminali collo della vescica, sfintere esterno, retto, muscoli elevatori dell'ano e/o parete pelvica
N1 invasione dei linfonodi regionali
COLLO DELL' UTERO (PORTIO)
(Si riporta il corrispondente Stadio FIGO - Federaz. Intern.Ginecologi Ostetrici - essendo il più usato)
TNM FIGO
TX il tumore non può essere definito
T0 non segni di tumore
Tis 0 carcinoma in situ
T1 I carcinoma cervicale limitato all'utero
T1a IA carcinoma invasivo preclinico con diagnosi microscopica
T1a1 IA1 minima invasione stromale microscopica
T1a2 IA2 invasione max di 5 mm in profondità e 7 mm in orizzontale
T1b IB dimensioni maggiori di T1a2
T2 II carcinoma cervicale con invasione oltre l'utero ma senza raggiungere la parete pelvica o il terzo inferiore della vagina
T2a IIA senza invasione dei parametri
T2b IIB con invasione dei parametri
T3 III carcinoma cervicale con estensione alla parete pelvica e/o
invasione del terzo inferiore della vagina e/o
idronefrosi o rene non funzionante
T3a IIIA invade il terzo inf. della vagina senza estensione alla parete pelvica
T3b IIIB esteso alla parete pelvica e/o idronefrosi o rene non funzionante
T4 IVA invasione della mucosa della vescica o del retto e/o esteso oltre la piccola pelvi
M1 IVB metastasi a distanza
N1 invasione dei linfonodi regionali
TNM FIGO
TX il tumore non può essere definito
T0 non segni di tumore
T1 I tumore limitato alle ovaie
T1a IA limitato a un ovaio, capsula integra, assenza di cellule maligne nell'ascite o nel liquido di lavaggio peritoneale
T1b IB limitato ad entrambe le ovaie, capsula integra, assenza di cellule maligne nell'ascite o nel liquido di lavaggio peritoneale
T1c IC limitato a una o entrambe le ovaie, con rottura capsulare, presenza di cellule maligne nell'ascite o nel liquido di lavaggio peritoneale
T2 II tumore che interessa una o entrambe le ovaie con estensione alla pelvi
T2a IIA tumore esteso a utero e tuba, assenza di cellule maligne nell'ascite o nel liquido di lavaggio peritoneale
T2b IIB tumore esteso agli altri organi pelvici, assenza di cellule maligne nella ascite o nel liquido di lavaggio peritoneale
T2c IIC tumore esteso agli organi pelvici, con presenza di cellule maligne nella ascite o nel liquido di lavaggio peritoneale
T3 +/- N1 III tumore che interessa una o entrambe le ovaie con metastasi peritoneali e/o nei linfonodi regionali
T3a IIIA metastasi peritoneali extrapelviche microscopiche
T3b IIIB metastasi peritoneali extrapelviche macroscopiche inferiori a 2 cm
T3c +/-N1 IIIC metastasi peritoneali extrapelviche superiori a 2 cm e/o metastasi ai linfonodi regionali
M1 IV metastasi a distanza (le metastasi peritoneali sono escluse)
N1 invasione dei linfonodi regionali
Si descrivono due esempi di stadiazione: per il tumore del polmone e per il tumore della mammella. Si ricorda ancora che il TNM ha valore descrittivo della estensione della malattia, mentre il raggruppamento in stadi ha valore prognostico e terapeutico, nel senso che neoplasie con TNM differenti ma appartenenti allo stesso stadio hanno comportamenti analoghi e quindi trattamenti terapeutici simili.
STADI CARCINOMA POLMONARE |
|
STADIO T N M |
carcinoma occulto TX N0 M0 |
stadio 0 Tis N0 M0 |
stadio I T1 N0 M0 |
T2 N0 M0 |
stadio II T1 N1 M0 |
T2 N0 M0 |
stadio IIIA T1 N2 M0 |
T2 N2 M0 |
T3 N0, N1, N2 M0 |
stadio IIIB T1,T2,T3 N3 M0 |
T4 ogni N M0 |
stadio IV ogni T ogni N M1 |
STADI DEL CARCINOMA MAMMARIO |
|
TNM T N M |
stadio 0 Tis N0 M0 |
stadio I T1 N0 M0 |
stadio IIA T0 N1 M0 |
T1 N1 M0 |
T2 N0 M0 |
stadio IIB T2 N1 M0 |
T3 N0 M0 |
stadio IIIA T0 N2 M0 |
T1 N2 M0 |
T2 N2 M0 |
T3 N1,N2 M0 |
stadio IIIB T4 ogni N M0 |
ogni T N3 M0 |
stadio IV ogni T ogni N M1 |
Quando l'oncologo è in possesso della diagnosi istologica e della stadiazione può predisporre il piano terapeutico.
Essendo il tumore maligno una malattia multiforme che, non solo può interessare tutti gli organi e apparati, ma nello stesso organo si può presentare in forme diverse, necessita di un approccio terapeutico complesso e multidisciplinare. Per semplificazione riportiamo questo schema generale:
CHIRURGIA | PREVENTIVA
| DIAGNOSTICA (BIOPSIA)
| TERAPEUTICA (CURATIVA)
| RIDUTTIVA - PALLIATIVA
RADIOTERAPIA | PRECAUZIONALE
| TERAPEUTICA (CURATIVA)
| PALLIATIVA
CHEMIOTERAPIA | NEOADIUVANTE
| ADIUVANTE
| TERAPEUTICA (CURATIVA)
| DI MANTENIMENTO
| PALLIATIVA
ORMONOTERAPIA
IMMUNOTERAPIA
TERAPIA DI SUPPORTO (PALLIATIVA)
Il trattamento chirurgico, quando è possibile, è di prima scelta perchè può garantire la guarigione.
Come esposto, vi sono vari tipi di chirurgia:
La chirurgia preventiva è effettuata quando si è in presenza di lesioni o malattie che possono degenerare in tumore maligno con elevata frequenza statistica. Ad esempio la colite ulcerosa recidivante che spesso degenera in adenocarcinoma del colon, la ritenzione dei testicoli in cavità addominale, lesioni croniche del cavo orale, ecc. In questi casi si deve effettuare un intervento chirurgico conservativo risparmiando il più possibile i tessuti sani o ritenuti tali.
La chirurgia diagnostica si pone lo scopo di asportare piccole quantità di tessuto sospetto da sottoporre all'esame istologico: si tratta normalmente di noduli cutanei o sottocutanei, linfonodi superficiali, ma anche interventi più complessi laparotomici o in cavità toracica. Spesso questa tecnica è sostituita da prelievi con ago sottile, anche in organi profondi (polmone, fegato, rene, ecc.) sui quali si effettua un esame citologico.
La chirurgia terapeutica vera e propria si attua quando vi è la certezza di una massa tumorale in un organo. Sono interventi altamente demolitivi avendo lo scopo di asportare tutto il tessuto tumorale e parte di quello sano circostante; inoltre vi è la necessità di asportare e analizzare le stazioni linfonodali loco regionali.
La chirurgia palliativa e riduttiva si applica quando la massa tumorale è molto grande, oppure quando i rischi operatori sono elevati, oppure quando la presenza di metastasi controindicano interventi chirurgici impegnativi. Lo scopo è ridurre la massa tumorale per migliorare la qualità di vita senza fini di guarigione. Nell'ambito della multidisciplinarietà è possibile programmare in un tempo successivo un trattamento radioterapico e/o chemioterapico.
TERAPIA RADIANTE (RADIOTERAPIA)
Questo tipo di cura si avvale dell'uso di radiazioni elettromagnetiche o corpuscolari che hanno la possibilità di distruggere le cellule tumorali senza danneggiare in modo irreversibile le cellule sane. E' una terapia locale come la chirurgica, in quanto agisce solo sulla quantità di tessuto che viene colpito dalle radiazioni.
Le radiazioni corpuscolari più usate sono:
Particelle beta emesse da elementi radioattivi come il cobalto.
Elettroni accelerati ottenuti con l'uso di apparecchi speciali come il betatrone o accelatore lineare.
Le radiazioni elettromagnetiche sono:
Raggi gamma provenienti da sostanze radioattive.
Raggi X accelerati ottenuti da elettroni che urtano contro un bersaglio.
Il potere di penetrazione e di distruzione dei tessuti dipende dalla loro energia misurata in Kilo e Mega elettron-Volt ( keV MeV).
La loro azione biologica viene misurata in "rad" che esprime l'energia assorbita da un grammo di tessuto colpito. Attualmente è usato il Gray (Gy) pari a 100 rad.
[Per ulteriori informazioni si consiglia la consultazione di testi specializzati].
Quanto maggiore è l'energia dei raggi utilizzati e i gray somministrati, tanto maggiore è la possibilità di successo terapeutico.
Oltre che danneggiare il tessuto neoplastico le radiazioni danneggiano anche i tessuti sani sebbene in minor misura. Per ridurre i danni sarà necessario programmare le dosi nel tempo e proteggere il più possibile i tessuti sani.
I danni che comunemente si rilevano sono dermatiti e mucositi, oltre che fibrosi dei vari connettivi. In caso di superfici irradiate molto estese vi è la possibilità di nausea e vomito (malattia da raggi).
Se viene irradiato il midollo emopoietico, si riscontrerà leuco-piastrinopenia e in un tempo successivo, anemia.
L'irradiazione delle gonadi comporta sterilità permanente.
L'irradiazione di zone pilifere comporta alopecia permanente.
Per la particolare gravità si segnala la possibilità di fibrosi polmonare e cardiaco con conseguente deficit d’organo. Campi radioterapici che interessano la pelvi possono avere quali conseguenze mucositi del retto e della vescica con tenesmo rettale e cistiti da raggi. Segnaliamo inoltre la possibilità di fistole degli organi pelvici (es.: retto vescicali, rettovescico vaginali, ecc.) con notevole compromissione della qualità di vita.
A seconda dello scopo per cui è impiegata, riconosciamo una radioterapia precauzionale avente lo scopo di "sterilizzare" una zona sottoposta precedentemente a chirurgia. Esempio tipico è la radioterapia impiegata dopo mastectomia.
La radioterapia terapeutica o curativa viene usata come primo trattamento con lo scopo di curare la neoplasia: è impiegata soprattutto nelle forme linfomatose.
La radioterapia palliativa ha lo scopo di ridurre masse neoplastiche per migliorare la qualità di vita dei pazienti, oppure nel trattamento localizzato di metastasi specialmente ossee.
Ricordiamo che sempre più frequentemente la radioterapia viene impiegata prima della chirurgia per permettere al chirurgo di asportare masse tumorali più piccole e quindi sottoporre i pazienti a interventi meno demolitivi.
E' una terapia sistemica in quanto agisce su tutto l'organismo.
Vengono usati farmaci che hanno la proprietà di interferire sul ciclo cellulare provocando la morte delle cellule oppure il blocco della riproduzione. I farmaci possono interferire in qualsiasi punto del ciclo cellulare (che ricordiamo con lo schema sottoriportato) con azione minima nella fase G0 in cui la cellula è a riposo e quindi con metabolismo ridotto.
Diamo un elenco delle principali classi di farmaci antiblastici con i nomi commerciali e le sigle comunemente usate.
antagonista dell'acido folico methotrexate METHOTREXATE MTX
analoghi basi azotate 5-fluoro-uracile FLUOROURACILE 5 FU
6-mercapto-purina PURINETHOL 6 MP
6-tio-guanina THIOGUANINA 6 TG
citosina arabinoside ARACYTIN ARA C
inibitori sintesi proteica L-asparaginasi CRASNITIN ASP
inibitori sintesi acidi nucleici idrossiurea ONCO-CARBIDE HYU
carmustina NITRUMON BCNU
lomustina BELUSTINA CCNU
procarbazina NATULAN PCZ
alchilanti busulfan MYLERAN,MISULBAN BSF
dacarbazina DETICENE,DTIC-DOME DTIC
mecloretamina CARYOLISIN,MUSTARGEN HN2
clorambucil LEUKERAN,LINFOLYSIN CLB
ciclofosfamide ENDOXAN CTX
ifofosfamide HOLOXAN IFO
melphalan ALKERAN PAM
agenti sulla trascrizione adriamicina ADRIBLASTINA ADM
(antibiotici antitumorali) epirubicina FARMORUBICINA EPI
mitomicina C MITOMYCIN MMC
radiomimetici bleomicina BLEOMICINA BLEO
veleni del fuso mitotico vincristina VINCRISTINA VCR
vinblastina VELBE VLB
teniposide VM 26 VUMON VM26
etoposide VP 16 VEPESID VP16
pacitaxel TAXOL
docetaxel TAXOTERE
azione aspecifica cloroplatino PLATINEX,CISPLATINO CDDP PLATAMIDE,CITOPLATINO
carboplatino PARAPLATIN CBDCA
Il trattamento antiblastico può essere neoadiuvante, quando viene effettuato prima di un intervento chirurgico o radiante allo scopo di ridurre le dimensioni del tumore ed effettuare un trattamento meno invasivo.
Può essere adiuvante quando i farmaci vengono somministrati dopo una chirurgia demolitiva, per ridurre le possibilità di recidiva sia locale che metastatica.
In vari casi la chemioterapia si pone l'obiettivo di distruggere tutto il tumore come nei linfomi o nelle leucemie, cioè terapeutica o curativa.
Specie nella cura delle leucemie infantili dopo un primo trattamento intensivo, è necessario somministrare piccole quantità di farmaci per lungo tempo, cioè si fa una terapia di mantenimento.
Per ultimo la chemioterapia può essere palliativa nel tentativo di prolungare o meglio, migliorare la qualità di vita, senza speranze di guarigione.
Il trattamento del tumore prevede, anche se raramente, l'uso di un solo farmaco, cioè la monochemioterapia oppure, più frequentemente, vengono associati due o più farmaci, cioè la polichemioterapia.
L'impiego della polichemioterapia trova il suo razionale nella valutazione della dinamica del ciclo cellulare. In qualsiasi tessuto, tumorale o meno, le cellule sono statisticamente distribuite in tutte le varie fasi del ciclo cellulare in quantità variabile e in funzione del grado di attività delle cellule stesse. Perciò in un famiglia cellulare un certo numero sarà in mitosi, contemporaneamente altre saranno in S, G0, G1, G2. Usando un solo farmaco ad esempio un veleno del fuso, la sua azione si esplicherà solo su quella frazione di cellule che si trovano all'inizio della mitosi; le altre saranno risparmiate. Al cessare della azione del farmaco il ciclo riprenderà normalmente, anzi una aliquota delle cellule in riposo G0 verrà trasferita in G1 e quindi in S. Le cellule lesionate e distrutte rappresentano una piccola parte di quelle presenti. Usando invece un farmaco veleno del fuso contemporaneamente a uno che impedisce la sintesi del DNA, si verranno a bloccare due siti cellulari con un maggior numero di cellule danneggiate. Aggiungendo altri farmaci che agiscano in momenti ancora differenti l'azione sarà più efficace, inoltre è possibile ridurre i dosaggi di ciascun prodotto, a vantaggio di una minore tossicità globale.
Sfruttando la cinetica cellulare, i farmaci vengono somministrati in tempi refratti, per far sì che vi siano più cellule possibili nel ciclo interessato dal farmaco stesso, giustificando la somministrazione ciclica (ogni 3 settimane oppure 7 giorni, ecc. a seconda dei casi).
Nel Grafico si riporta un modello ideale di terapia antiblastica.
Considerando la variabilità di comportamento delle varie neoplasie, non tutte rispondono in modo adeguato alla chemioterapia. Nella tabella viene proposto indicativamente un elenco di neoplasie e la relativa risposta ai farmaci antiblastici.
POSSIBILITA DI GUARIGIONE AUMENTO DELLA SOPRAVVIVENZA
leucemia linfoblastica acuta linfoma non Hodgkin follicolare
leucemia mieloblastica acuta leucemie croniche
linfoma di Hodgkin mieloma multiplo
linfoma non Hodgkin alto grado malignità policitemia vera
coriocarcinoma femminile neuroblastoma
sarcoma di Ewing carcinoma della mammella
tumore di Wilms carcinoma della prostata
carcinoma ovarico carcinoma dell'endometrio
carcinoma del testicolo sarcoma dei tessuti molli
carcinoma a piccole cellule del polmone osteosarcoma
MIGLIORAMENTO CLINICO RISPOSTA MARGINALE
carcinoma della vescica carcinoma del rene
carcinoma dell'esofago carcinoma del colon retto
carcinoma del pene carcinoma della portio uterina
carcinoma della tiroide carcinoma del pancreas
carcinoma squamoso del polmone adenocarcinoma del polmone
carcinoma del rinofaringe melanoma maligno
carcinoma epatocellulare
carcinomi squamosi del capo-collo
carcinoma della cute
I risultati terapeutici che si ottengono con la chemioterapia sono statistici e non clinici.
Infatti la riduzione delle cellule tumorali è in accordo con la cinetica di primo ordine, per cui ad ogni somministrazione di farmaco si riducono le cellule di una percentuale e non di un numero costante di queste.
Ad esempio, immaginiamo di avere una massa tumorale formata da un milione (1.000.000) di cellule e che il trattamento antiblastico le riduca del 99%: ne rimarrà l'1% pari a 10.000. Un secondo trattamento le porterà a 100. Un terzo trattamento ci permetterà di avere una sola cellula neoplastica. Ma nel periodo che intercorre tra i vari trattamenti avremo la moltiplicazione cellulare, che come sappiamo, è particolarmente vivace nelle cellule neoplastiche, perciò al secondo trattamento non avremo le 10.000 cellule previste ma una aliquota maggiore, e così per gli altri cicli. In pratica la chemioterapia si pone l'obiettivo di ridurre il numero le cellule anomale a valori talmente bassi da ipotizzare che possano essere distrutte dal sistema immunitario, ma ciò non corrisponde alla distruzione totale delle cellule (guarigione clinica), ma all'ipotesi che ciò avvenga (ipotesi che non si verifica in tutti i casi), per cui abbiamo la "probabilità" di guarigione, cioè una guarigione statistica.
Per valutare l'efficacia della chemioterapia si sono studiati dei criteri di risposta:
Risposta completa RC :scomparsa di tutte le manifestazioni note della malattia dopo almeno 4 settimane dalla terapia e quindi dalla prima osservazione.
Risposta parziale RP :Riduzione del 50% o più delle dimensioni tumorali note della malattia dopo almeno 4 settimane dalla terapia e quindi dalla prima osservazione.
Nessun cambiamento NC : Riduzione inferiore al 50% delle dimensioni tumorali note della malattia dopo almeno 4 settimane dalla terapia e quindi dalla prima osservazione, oppure un aumento delle dimensioni inferiore al 25% di quelle iniziali.
Progressione di malattia P : aumento superiore al 25% di quelle iniziali sempre dopo almeno 4 settimane.
Gli antiblastici, oltre che sulle cellule tumorali, svolgono la loro azione anche sulle cellule sane provocando uno stato di tossicità che si può evidenziare in vari organi e apparati.
A questo proposito riconosciamo una tossicità immediata (nausea, vomito, anafilassi) che si verifica al momento della somministrazione dei farmaci e una tossicità tardiva (mielodepressione, alopecia, mucositi, stomatiti, cistiti, cardiotossicita, neurotossicita centrale e periferica, nefrotossicita, ototossicita, ecc) che si verifica a distanza di una o più settimane dalla somministrazione. In certi casi vi è la necessità di interrompere la terapia proprio a causa degli effetti tossici.
Per convenzione la gravità dei sintomi è stata classificata in gradi di cui diamo una panoramica:
TOSSICITA |
GRADO 0 |
GRADO 1 |
GRADO 2 |
GRADO 3 |
GRADO 4 |
|
|
|
|
|
|
EMATOLOGICA |
|
|
|
|
|
emoglobina gr/dl |
sup a 11 |
10,9-9,5 |
9,4-8,0 |
7,9-6,5 |
inf a 6,5 |
leucociti n° |
sup a 4.000 |
3.900-3.000 |
2.900-2.000 |
1.900-1.000 |
inf a 1.000 |
granulociti n° |
sup a 2.000 |
1.900-1.500 |
1.400-1.000 |
900-500 |
inf a 500 |
piastrine n° |
sup a 100.000 |
99.000-75.000 |
74.000-50.000 |
49.000-25.000 |
inf a 25.000 |
emorragia |
assente |
petecchie |
modesta perdita ematica |
considerevole perdita ematica |
perdita ematica debilitante |
|
|
|
|
|
|
GASTROINTESTINALE |
|
|
|
|
|
nausea-vomito |
assente |
nausea |
vomito transitorio |
vomito che richiede terapia |
vomito intrattabile |
cavo orale |
indenne |
eritema bruciore |
eritema ulcere dieta solida possibile |
ulcere solo dieta liquida |
alimentazione impossibile |
diarrea |
assente |
transitoria inf a 2 giorni consecutivi |
tollerabile ma super. a 2gg consecutivi |
intollerabile richiede terapia |
emorragica disidratazione |
stipsi |
assente |
lieve |
moderata |
con distensione addominale |
con distensione addominale e vomito |
|
|
|
|
|
|
POLMONARE |
normale |
sintomi aspecifici |
dispnea da sforzo |
dispnea a riposo |
obbligato a letto |
|
|
|
|
|
|
FEBBRE (da chemioterapia) |
assente |
< 38°C |
38-40°C |
>40°C |
febbre con collasso |
|
|
|
|
|
|
SISTEMA PILIFERO |
nessuna perdita |
perdita minima dei capelli |
alopecia a zone |
alopecia completa ma reversibile |
alopecia irreversibile |
|
|
|
|
|
|
RENALE |
|
|
|
|
|
proteinuria |
assente |
1+ (< 0,3 g/100 dl) |
2-3+ ( 0,3 -1.0g/100 dl) |
4+ (>1.0 g/100 dl) |
sindrome nefrosica |
ematuria |
assente |
microscopica |
macroscopica |
macrosc.+coaguli |
uropatia ostruttiva |
Nell'ambito globale del trattamento oncologico è importante definire le condizioni generali del paziente (Performance Status).
Per rispondere ad esigenze di obiettività, vengono usate delle scale di valutazione di cui riportiamo le due più usate.
PERFORMANCE STATUS (P.S.)
Indice secondo KARNOSKY
100- normale,nessun sintomo,non evidenza di malattia
90- in grado di svolgere attività normale,lievi sintomi o segni di malattia
80- attività normale svolta con fatica,qualche segno o sintomo di malattia
70- autosufficiente,ma incapace di normale attività lavorativa
60- necessita di assistenza saltuaria,ma quasi completamente autonomo
50- richiede notevole assistenza e frequenti cure mediche
40- inabile,necessita di assistenza e cure speciali
30- in gravi condizioni,è indicata l'ospedalizzazione
20- molto grave,necessaria l'ospedalizzazione con intensa terapia di supporto
10- moribondo,pre-terminale
0- decesso
(Eastern Cooperative Oncology Group)
1- piena attività compatibilmente con l'età
2- capace di lavoro leggero, paziente ambulatoriale
3- accudisce a se stesso, incapace di lavorare, allettato per meno del 50% delle ore diurne
4- parzialmente in grado di accudire a se stesso, allettato per più del 50% delle ore diurne
5- totalmente inabile, completamente allettato
E' una terapia mirata per alcuni tipi di tumori ormonodipendenti quali il cancro della mammella, della prostata, della tiroide, ecc.
Considerata l’importanza che riveste per la loro frequenza, riportiamo in dettaglio il trattamento ormonale per i tumori della mammella e della prostata
In passato la manipolazione ormonale era quasi sempre cruenta come la ovariectomia e la orchiectomia allo scopo di eliminare la produzione rispettivamente degli ormoni sessuali femminili e maschili. Attualmente tali interventi sono limitati a qualche caso selezionato che non risponde ai farmaci ormonali.
In particolare, per il tumore della mammella si utilizzano ormoni simili agli estrogeni e ai progestinici in modo che occupino i recettori ormonali presenti sulle cellule, per cui l'ormone naturale trovando il sito recettoriale impegnato non può svolgere la sua azione. E' indispensabile che l'affinità dell'antiestrogeno per il recettore sia maggiore di quella dell'ormone naturale.
Per il tumore della prostata si effettua un blocco totale degli androgeni somministrando farmaci analoghi a LH-RH (ormoni rilascianti gonadotropine) che ad alte dosi rendono insensibili i recettori testicolari alle gonadotropine ipofisarie (LH), bloccando la produzione del testosterone, inoltre si impiegano degli antiandrogeni per bloccare gli ormoni sessuali maschili di origine surrenalica.
Gli analoghi LH-RH, utilizzati inizialmente per il tumore della prostata, attualmente vengono utilizzati anche nel carcinoma della mammella provocando una menopausa farmacologica e permettendo quindi l’impiego di antiestrogeni come il tamoxifene anche in pazienti giovani.
Se tali terapie raramente concedono la guarigione, permettono un importante prolungamento della vita senza creare disagi particolari, avendo una buona tolleranza e modesti effetti collaterali. Riportiamo un elenco delle sostanze ormonali più frequentemente usate.
tamoxifene Nolvadex antiestrogeno: si lega ai recettori degli estrogeni Kessar impedendone l'azione; blocco della sintesi del DNA con accumulo di cellule in G1. Usato per cr. mammella.
medrossiproge- Provera progestinico, si comporta come antiestrogeno. Usato
sterone acetato Farlutal per cr. mammella, endometrio, rene.
megestrolo ace- Megace progestinico, come il medrossiprogesterone acetato
tato Megestil
aminoglutetimide Orimeten sopprime l'attività del corticosurrene inibendo l'enzima aromatasi.Viene bloccata la sintesi di tutti gli ormoni corticosurrenalici.
Farmaco storico usato per cr. mammella.
Anastrazolo Arimidex sopprime l'attività del corticosurrene inmodo selettivo inibendo l'enzima aromatasi.Viene bloccata solo la sintesi degli ormoni sessuali.
Farmaco usato per cr. Mammella
Exemestane Aromasin Simile all’anastrazolo
flutamide Eulexin antiandrogeno. Non chiaro il meccanismo di azione. Usato per cr.prostata.
ciproterone acetato Androcur come la flutamide.
leuprolide Enatone analogo LH-RH provoca castrazione chimica.
Usato per cr. prostata e mammella.
buserelin Suprefact come leuprolide
goserelin Zoladex come leuprolide
triptorelina Decapeptyl come leuprolide
E' noto che il sistema immunitario ha la capacità di riconoscere le cellule neoplastiche come elementi estranei e distruggerle, esercitando una funzione antitumorale. Questa azione può diventare insufficiente quando le cellule atipiche sono molto simili a quelle normali (neoplasie differenziate) con azione antigenica molto scarsa, oppure quando l'aggressività del tumore è elevata per cui ha il sopravvento sulle difese immunitarie, oppure quando il sistema immunitario è carente come nella immunodeficienza congenita o nella immunodeficienza acquisita, situazione quest'ultima molto frequente nelle neoplasie avanzate ma soprattutto tipica nelle infezioni da HIV.
Sulla base di ciò, accanto alle ricerche sui farmaci antiblastici, si sono e si stanno studiando farmaci atti ad aumentare le difese dell'organismo e quindi distruggere le cellule neoplastiche.
Citiamo a titolo di esempio l'uso del vaccino BCG (Bacillo Calmette-Guerin) e del corynebacterium parvum quali agenti immunostimolanti usati nel passato e ancora oggi impiegati in casi selezionati. Il levamisolo quale immunopotenziatore e, recentemente l'impiego della interleuchina 2 con risposte soddisfacenti in alcuni casi di melanoma e di carcinoma renale.
Anche l'interferon sia da leucociti che da fibroblasti agisce su alcuni tipi rari di leucemie (tricoleucemia), in alcuni linfomi follicolari e nel mieloma.
Anche se negli anni passati la sperimentazione di questi farmaci ha fatto molto sperare, attualmente la immunoterapia non si può ancora considerare applicabile a largo raggio sia per i risultati nel complesso deludenti, sia per i costi elevati rispetto ai benefici che si ottengono.
In ogni caso è da considerare che l'inizio di queste sperimentazioni è iniziato circa 10 anni fa, quindi è troppo presto per una valutazione obiettiva definitiva.
L'utilizzo appropriato delle varie metodiche suesposte ha permesso di aumentare le speranze e di migliorare la qualità di vita dei pazienti affetti da patologia neoplastica, anche se la guarigione non è sempre possibile. E' opportuno sottolineare ancora una volta che le probabilità di guarigione sono condizionate dalle dimensioni del tumore iniziale, per cui una diagnosi precoce, è la migliore possibilità di successo.
A questo proposito si cita il Codice contro il Cancro proposto da un Comitato di Esperti Europei nel 1990 e ancora oggi non sufficientemente noto al pubblico.
L'applicazione di queste norme potrebbe ridurre di 10-15% le morti per cancro.
CODICE EUROPEO CONTRO IL CANCRO
Alcuni tipi di cancro possono essere evitati (prevenzione primaria)
1) Non fumate. Fumatori smettete di fumare al più presto e non fumate in presenza di altri.
2) Non eccedete nel consumo di alcolici, birra, vino o superalcolici.
3) Evitate l'eccessiva esposizione ai raggi solari.
4) Attenetevi scrupolosamente alle istruzioni relative ad aspetti di sanità e sicurezza, in particolare nell'ambiente di lavoro per quanto riguarda la produzione, la manipolazione o l'utilizzazione di qualsiasi sostanza potenzialmente cancerogena.
5) Mangiate frequentemente frutta fresca, verdure e cereali integrali.
6) Evitate di essere in sovrappeso e limitate il consumo di grassi.
Sarà possibile curare molti tipi di cancro con una diagnosi precoce
7) Consultate il medico se osservate un rigonfiamento, un cambiamento di aspetto di un neo o una perdita di sangue inspiegabile.
8) Rivolgetevi al medico se avete sintomi persistenti, quali tosse continua, raucedine, disturbi dell'apparato digerente o un'inspiegabile perdita di peso.
Per le donne (prevenzione secondaria)
9) Sottoponetevi regolarmente al PAP-test.
10) Controllatevi il seno regolarmente, specie dopo i 30 anni. Richiedete annualmente una visita al vostro medico completandola con almeno tre mammografie tra i 40 e i 50 anni; dopo i 50 anni sottoponetevi ogni due anni a mammografia.
Per terapia di supporto intendiamo tutti quei i presidi medico-chirurgici che vengono utilizzati per migliorare la qualità della vita sia durante il trattamento antitumorale specifico che nel periodo al di fuori di questo. Ci si riferisce in modo particolare al controllo dei sintomi legati agli effetti collaterali sia immediati che tardivi della radio e chemioterapia, al dolore post-operatorio nel caso di interventi chirurgici e nel dolore da cancro che si può verificare in qualsiasi momento.
Anche in questo campo sono stati fatti dei progressi, basti pensare all'impiego degli antiemetici antiserotoninergici (ondansetron-Zofran, granisetron-Kitril) che affiancandosi ai farmaci già esistenti (metoclopramide-Plasil) hanno permesso di superare il problema dell'emesi da chemioterapia con il vantaggio di un possibile aumento dei dosaggi dei farmaci migliorando la sopravvivenza.
L'introduzione dei fattori di crescita emopoietici, quali il M-CSF, il GM-CSF e il G-CSF (v. Sistema Immunitario), permettono l'uso di antiblastici fortemente mielodepressivi ad alto dosaggio. E per ultimo il trapianto di midollo, che oltre a fornire cellule multipotenti aumenta le difese immunitarie.
Per quanto riguarda il dolore la conoscenza approfondita della sua fisiopatologia e il conseguente uso sia di farmaci antalgici sia di metodiche più o meno invasive permette di eliminare questo sintomo in più dell'95% dei malati di cancro.
Quando la malattia raggiunge uno stadio avanzato, la terapia oncologica specifica non è più possibile, anzi può diventare dannosa e si propone il malato per la sola terapia palliativa.
La decisione di sospendere la terapia attiva dipende da alcuni criteri, che possono essere:
1) mancata risposta alle terapie specifiche: dopo vari cicli di chemioterapia e/o trattamento radiante si riscontra Nessun Cambiamento NC o Progressione di malattia P;
2) scadute condizioni generali del paziente (grave anemia, febbre elevata, cachessia, ecc.).
A questo proposito sono di grande utilità le scale di valutazione del Performance Status.
3) compromissione irreversibile di uno o più organi nobili come fegato, reni, cuore;
4) rifiuto del paziente di proseguire la terapia antiblastica a causa degli effetti collaterali.
La medicina palliativa si pone l'obiettivo di migliorare la qualità di vita dei pazienti curando i sintomi senza aver la pretesa di intervenire sul tumore.
Per sintomo si intende la manifestazione di una malattia che viene percepita dal paziente in senso disturbante come la febbre, il dolore, la tosse, il vomito, ecc.
Ricordiamo che il sintomo più preoccupante e temuto dal paziente e dai familiari è il dolore, per cui deve essere adeguatamente trattato fin dal suo esordio.
Altri sintomi che di frequente si incontrano nel malato oncologico terminale sono:
Il vomito, fastidioso se limitato a rari episodi, può compromettere il benessere del paziente se si prolunga nel tempo, con conseguenze anche irreparabili a causa della alimentazione e idratazione insufficienti.
L'insufficienza respiratoria che si incontra nei tumori e nelle metastasi polmonari, dove l'uso di ossigeno e di farmaci specifici, ad esempio broncodilatatori spesso è inefficace. Frequentemente si ricorre alla morfina che, impiegata a piccole dosi, riduce il senso di ansia e di oppressione e dà sollievo al paziente.
Ma altri sintomi, apparentemente modesti per una persona sana, sono estremamente fastidiosi per il paziente e tali da pregiudicare la qualità di vita e come ulteriori esempi si possono elencare la tosse fine a se stessa, cioè non presente come meccanismo di difesa per eliminare il muco dai bronchi e dalla trachea, ma come manifestazione di irritazione continua delle vie aeree, il singhiozzo, sintomo tra più difficili da eliminare e che può portare ad uno stato di prostazione e di rifiuto di vivere; il prurito generalizzato e continuo, l'astenia ecc.
A scopo illustrativo diamo di seguito una tabella con la frequenza percentuale dei sintomi rilevati nel 1991 in 187 pazienti terminali.
SINTOMO FREQUENZA %
astenia 77,0
dolore 73,3
anoressia 71,7
calo ponderale 50,3
stipsi 34,8
edema periferico 29,4
nausea 28,9
disturbi da catetere vescicale 28,3
disturbi del cavo orale 27,3
dispnea 21,4
vomito 21,4
tosse 20,3
ascite 29,8
ulcere da decubito 11,8
ittero 8,6
versamento pleurico 7,5
prurito 6,4
diarrea 4,3
singhiozzo 4,3
incontinenza sfinterica 3,2
La medicina palliativa inoltre si pone l'obiettivo ben più importante di "curare" il paziente terminale fino al decesso soddisfacendo le sue esigenze non solo fisiche ma anche psichiche, sociali e morali. Quindi una "cura globale " dove il malato è al centro dell'attenzione non solo del medico e dell'infermiere professionale, ma dello psicologo, dell'assistente religioso e soprattutto della famiglia.
PARTE SECONDA
NOMENCLATURA DEI TUMORI
Per una migliore comprensione della nomenclatura delle neoplasie si riportano alcuni cenni di embriologia.
All'inizio dello stadio embrionale riconosciamo tre foglietti primitivi altamente cellulati:
1) uno esterno ectoderma, aderente al trofoblasto,
2) uno più profondo endoderma formato dall'invaginazione del precedente,
3) un foglietto compreso tra i due, il mesoderma.
Questi tre foglietti, sviluppandosi, daranno luogo a tutte le strutture epiteliali, in particolare:
l'ectoderma costituirà cute e annessi (peli, ghiandole sudoripare, sebacee, mammella, ecc.);
l'endoderma formerà parte degli organi splancnici come il canale alimentare e, attraverso invaginazioni, le ghiandole annesse (compreso fegato e pancreas); le ghiandole endocrine che nella evoluzione, per obliterazione dei dotti, perdono i contatti con l'esterno; l' apparato respiratorio e ghiandole annesse.
Dal mesoderma originano gli organi dell'apparato genito-urinario (reni, vescica, utero, ovaie, testicolo, prostata).
Tra i tre foglietti suddetti esiste un "tessuto" poco cellulato e ricco in sostanza intercellulare: il mesenchima, che darà origine a tutti i connettivi e al tessuto muscolare sia liscio che striato.
(Vedi figure che schematizzano il processo di invaginazione e formazione dei tre foglietti dermici a partire dalla blastula. Per semplicità non è stato riportato nè il trofoblasto nè il mesenchima, quest'ultimo presente diffusamente tra le strutture dermiche stesse).
I tumori che originano dall'ectoderma, entoderma, mesoderma quindi di origine epiteliale sono denominati carcinomi. In particolare se mantengono l'aspetto dell'epitelio ghiandolare sono chiamati adenocarcinomi.
I tumori che originano dal mesenchima sono denominati genericamente sarcomi.
Per i sarcomi la nomenclatura è più complessa e si parlerà di:
Fibrosarcoma se l'origine è il tessuto connettivo lasso
Osteosarcoma se l'origine è il tessuto osseo
Condrosarcoma se l'origine è il tessuto cartilagineo
Liposarcoma se l'origine è il tessuto adiposo
Leiomiosarcoma se l'origine è il tessuto muscolare liscio
Rabdomiosarcoma se l'origine è il tessuto muscolare striato
Linfomi se l'origine è il tessuto linfoide
Leucemie se l'origine è il tessuto emopoietico midollare
Istologicamente un tessuto neoplastico potrà essere molto simile al tessuto maturo (differenziato) oppure simile al tessuto embrionale da cui è originato (indifferenziato). Ciò comporterà differenti velocità di accrescimento del tumore: relativamente basse per il primo, elevate per il secondo.
Il grado di differenziazione andrà ad influire sulla prognosi della storia naturale della malattia: favorevole per i tumori differenziati e sfavorevole per i tumori indifferenziati.
Vi è da precisare che nei riguardi di una eventuale terapia medica o radiante il comportamento si rovescia perchè le cellule immature, con elevata duplicazione, sono più sensibili ai farmaci e alla radioterapia quindi con maggior probabilità di successo.
Questa ulteriore complicazione fa intendere le difficoltà che l'oncologo incontra nel programmare una terapia adeguata.
Saranno descritti i principali carcinomi in funzione della loro sede.
Per quanto riguarda i sarcomi, in questa sede, non si ritiene opportuno la loro trattazione sia per la bassa incidenza globale rispetto ai carcinomi, che per la variabilità di questo tipo di neoplasie.
Le leucemie e i linfomi sono argomenti specifici di ematologia.
TUMORI DEL CAPO-COLLO O CERVICO-FACCIALI
Costituiscono un gruppo eterogeneo di neoplasie che interessano i tessuti del cavo orale e delle prime vie aeree-respiratorie. Istologicamente sono carcinomi squamosi ad esclusione di quelli che originano dalle ghiandole salivari (adenocarcinomi). Le localizzazioni sono:
Cavità orale: lingua, labbra, orofaringe, palato, pavimento buccale, guancia, gengive.
Rinofaringe
Laringe
Ipofaringe
Ghiandole salivari
Anche se rari si ricordano i linfomi che originano dalle strutture tonsillari.
I fattori di rischio riconosciuti sono il fumo di sigaro e di sigarette, l'alcool e per il cavo orale microtraumi delle mucose per protesi dentarie non correttamente posizionate.
E' da considerare lesione precancerosa la leucoplachia, zona biancastra di ipercheratosi della mucosa del cavo orale.
Questi carcinomi, se diagnosticati in fase iniziale, sono guaribili con terapia chirurgica. Ciò purtroppo avviene assai raramente perché i pazienti si presentano già con estese invasioni dei linfonodi locoregionali (v. Figura) e quindi con prognosi infausta.
La chirurgia è sempre altamente demolitiva e, considerata la localizzazione, invalidante per l'aspetto fisico. La radioterapia nelle forme iniziali è adiuvante alla chirurgia, così come la chemioterapia. Nelle forme avanzate sia la radio che la chemio hanno valore palliativo. Se il campo radioterapico interessa la laringe, spesso è necessario effettuare una tracheostomia preventiva per evitare il soffocamento da edema radioprovocato.
Frequenti le metastasi ai polmoni, al fegato, alle ossa anche se vengono di solito riscontrate alla autopsia, in quanto questi pazienti decedono precocemente per emorragie, infezioni locali che poi si estendono, polmoniti ab ingestis.
Attualmente nel programma terapeutico la chemioterapia e/o la radioterapia costituiscono il momento iniziale (neoadiuvante) precedendo la chirurgia al fine di ridurre la massa tumorale e poter effettuare interventi meno demolitivi.
Prevenzione: abolizione del fumo, riduzione dell'alcool, posizionamento corretto di protesi dentarie.
Diagnosi precoce: controlli e asportazione di leucoplachia, controllo clinico in caso di raucedine e/o di disfonia che non si risolve in breve tempo.
Con una frequenza statisticamente significativa si riscontrano secondi tumori polmonari in pazienti considerati guariti da tempo di tumori della laringe e/o dell’ipofaringe. Nel follow up è quindi indispensabile valutare questa possibilità.
Sintomi prevalenti in fase avanzata (palliazione): 1) DOLORE 2) ASTENIA legata a 3) ANORESSIA causata dal dolore 4) CACHESSIA.
TUMORI DEL TUBO DIGERENTE
Considerate le differenti caratteristiche trattiamo separatamente le neoplasie dei vari distretti.
Carcinoma dell'esofago: più frequente nei maschi in età avanzata (60-70 anni), fattori di rischio fumo e alcool. Si riscontra una elevata incidenza nei paesi dell'Estremo Oriente.
Il sintomo principale è la disfagia prima ai solidi e poi ai liquidi.
La forma istologica comune è il carcinoma epidermoide se insorge nel 1/3 superiore (frequenza 15%) e nel 1/3 medio (frequenza 50%), presenza anche di adenocarcinomi nel 1/3 inferiore (frequenza 35%).
La diagnosi è posta con Rx al pasto baritato oppure con esofagoscopia che permette il prelievo di tessuto per l'esame istologico.
Quando possibile la terapia è chirurgica, la radioterapia ha valore palliativo, inutile o quasi la chemioterapia (in monochemioterapia solo cisplatino con risposta parziale del 20-25%, in polichemioterapia risposta parziale 30-50% con breve periodo di remissione). Nel caso di massa ostruente il lume esofageo, a scopo palliativo, è possibile la resezione di parte del tumore con laser. Frequenti le invasioni per contiguità del mediastino in quanto l’esofago è privo di sierosa.
La prognosi è quasi sempre infausta entro un anno decessi del 75%.
Sintomi prevalenti in palliazione: 1) DISFAGIA a solidi e liquidi, 2) DOLORE, 3) CACHESSIA, 4) ASTENIA, 5) EMORRAGIE spesso imponenti che portano rapidamente al decesso per shock emorragico, 6) DISPNEA se invasione mediastinica, 7) se è interessato l’esofago medio frequenti le FISTOLE esofago tracheo bronchiali con possibili broncopolmoniti ab ingestis.
Carcinoma dello stomaco: In Europa e America del Nord la sua incidenza è di molto diminuita in questo ultimi anni, continua ad essere frequente nell'Estremo Oriente. Il fattore di rischio principale è l'alimentazione specie con cibi conservati (salatura, affumicatura). L'età più colpita 50-60 anni.
La forma istologica prevalente è l'adenocarcinoma.
I sintomi, spesso aspecifici, comprendono dispepsia, pirosi, epigastralgie, frequenti le microemorragie con sangue occulto nelle feci e conseguente anemia sideropenica (spesso il primo sintomo).
La diagnosi viene posta con gastroscopia e biopsia della lesione evidenziata.
La terapia di elezione è chirurgica con gastrectomia totale allargata ai linfonodi locoregionali. In fase avanzata sono molto frequenti le metastasi epatiche, peritoneali e pancreatiche, queste ultime per invasione diretta, frequenti anche le metastasi polmonari. La radioterapia ha valore palliativo, la chemioterapia non apporta alcun vantaggio. Attualmente per migliorare la qualità di vita nelle forme metastatiche è consigliato l'uso di uno schema chemioterapico a bassa tossicità con fluorouracile e acido folico o derivati.
Sintomi prevalenti in palliazione: 1) DOLORE epigastrico spesso irradiato al dorso per compromissione del tripode celiaco o alle spalle per invasione diaframmatica, 2) ANORESSIA, 3) CACHESSIA, 4) EMORRAGIE DIGESTIVE a volte imponenti.
Si trascurano i tumori dell'intestino tenue perché piuttosto rari. La prognosi è comunque infausta a causa dei rari sintomi iniziali per cui alla diagnosi, il tumore è quasi sempre diffuso al peritoneo. Istologicamente sono degli adenocarcinomi
Carcinomi del colon-retto: Frequenti in USA e Europa, l'incidenza è pressoché uguale nei due sessi e colpisce in prevalenza soggetti superiori ai 50 anni. Le poliposi a carattere familiare e la colite ulcerosa sono considerate lesioni precancerose, quindi devono essere seguite in modo particolare. Fattori di rischio sono le diete a basso contenuto in fibre vegetali e ricche di grassi animali e proteine. Istologicamente sono tutti adenocarcinomi. I sintomi comprendono alterazioni non giustificate dell'alvo e sangue nelle feci.
La diagnosi viene posta con clisma opaco, colonrettoscopia e relativa biopsia della lesione.
Metastatizza al fegato oltre che ai linfonodi addominali, frequente l'invasione della cavità peritoneale.
La terapia di elezione è chirurgica, la radioterapia ha funzione palliativa come la chemioterapia che viene utilizzata come per il cancro gastrico.
Il decorso è molto lungo, anche vari anni, con discreta qualità di vita che è compromessa nei portatori di ano artificiale.
Sintomi prevalenti in palliazione: 1) DISTURBI dell’alvo che diventano imponenti nel caso di occlusione non trattabile chirurgicamente, 2) D0LORE ADDOMINALE, 3) TENESMO RETTALE nei tumori del retto-ano, 4) EMORRAGIE DIGESTIVE e RETTORRAGIE.
Il quadro diventa più complesso nel caso di metastasi epatiche e i sintomi dominanti sono riferibili alla insufficienza di questo organo.
Carcinomi del fegato, pancreas, vie biliari: Poco frequenti, anche se attualmente sono in aumento i tumori del pancreas negli anziani di età superiore ai 70 anni. Sono tutti adenocarcinomi. I sintomi sono aspecifici, epigastralgie, dispepsia, dolori addominali. Quasi sempre la diagnosi avviene in fase avanzata di malattia con ecotomografia e TAC addominale. Frequente l'invasione peritoneale.
Per i tumori del fegato il rischio principale è la presenza di cirrosi sia alcolica sia HCV correlata con trasformazione in cancrocirrosi.
Il trattamento chirurgico è l'indicazione principale ma, a causa del ritardo diagnostico, la sopravvivenza a 5 anni si aggira sull'1-2% dei casi. Radioterapia e chemioterapia come per i tumori del tratto gastrointestinale.
Per i tumori primitivi del fegato sono state sperimentate varie tecniche (es.: alcolizzazione, chemioterapia intraoperatoria, radioterapia intraoperatoria) senza risultati significativi.
Sintomi prevalenti in palliazione: 1) ITTERO, 2) ENCEFALOPATIA PORTOSISTEMICA, 3) ASCITE, 4) EDEMA PERIFERICO all’inizio che diventa 5) ANASARCA in fase avanzata, 6) COMA EPATICO, 7) DOLORE che può essere presente fin dall’inizio nel carcinoma del pancreas (corpo coda) per invasione del tripode celiaco.
Prevenzione: nessuna per tutti i tipi di tumore sopraelencati
Diagnosi precoce: ricerca del sangue occulto nelle feci; controlli clinici in caso di variazioni ingiustificate dell'alvo; follow up stretto nelle cirrosi epatiche (anche se la diagnosi precoce non comporta grandi vantaggi sulla sopravvivenza).
TUMORI DEL POLMONE
E' il tumore a più alta incidenza nel maschio (il rapporto maschi/femmine è di circa 10/2) nella fascia di età 60-70 anni.
Esiste una relazione ben definita tra fumo della sigaretta e cancro, altro fattore importante è l'inquinamento atmosferico sia da fumi da riscaldamento sia da combustione di benzina e derivati.
Si riconoscono varie forme istologiche con comportamenti differenti:
carcinoma epidermoide 40% di tutti i casi
carcinoma a grandi cellule 20%
carcinoma a piccole cellule 20%
adenocarcinoma 10%
altri tipi più rari 10%
Si descrivono i due tipi più significativi.
Carcinoma epidermoide o a cellule squamose, è il tipo più frequente. Istologicamente è un carcinoma a cellule squamose. Origina dalla mucosa bronchiale con possibilità di ostruzione del bronco, le emorragie sono frequenti. Tra i sintomi iniziali prevale la tosse non produttiva, l’escreato striato di sangue, a volte dolore toracico; la dispnea può essere presente inizialmente anche se è il sintomo prevalente nella fase avanzata di malattia.
La diagnosi è posta quasi sempre con Radiografia del torace nelle proiezioni ortogonali. La fibro broncoscopia permette di perfezionare la diagnosi e attraverso la biopsia mirata identificare la istologia. La diagnosi viene perfezionata con la TAC toracica specie se le localizzazioni iniziali sono paramediastiniche, parailari o apicali.
La crescita è lenta e le metastasi non sono molto frequenti.
Quando è possibile la terapia chirurgica rappresenta l'indicazione principale con possibilità di guarigione. Comunque si stima che non più del 10% dei pazienti possa essere sottoposto a resezione chirurgica curativa.
La radioterapia ha valore palliativo riducendo le masse endobronchiali e quindi migliorando la qualità di vita.
La chemioterapia ha poco successo.
Carcinoma a piccole celle (microcitoma), ha un comportamento del tutto particolare. Le cellule tumorali sono piccole e infiltrano le sottomucose bronchiali, raramente si riuniscono in masserelle se non nella fase avanzata per cui i sintomi sono molto modesti e aspecifici. L’istologia per questo tipo di tumori è particolare. Metastatizza rapidamente e con elevata frequenza in quasi tutti gli organi e apparati, tanto che, spesso, al momento della diagnosi le metastasi sono già diffusamente presenti. Le colonizzazioni metastatiche prevalenti si riscontrano nel mediastino, nel fegato, nell’encefalo, nello scheletro, nei surreni.
Rispondono bene alla chemioterapia, anche se a causa della diffusione della malattia iniziale i successi sono modesti (circa 10-15%). Non è indicata la chirurgia a causa della estensione della malattia.
Nel microcitoma non esiste correlazione con il tabacco.
Per gli altri tipi istologici i risultati sono altrettanto modesti.
Prevenzione: abolizione del fumo di sigaretta.
Diagnosi precoce: nessuna
Sintomi prevalenti in fase avanzata: Dispnea, febbre, cachessia, tosse, emoftoe. Per il microcitoma prevalgono i sintomi legati alle lesioni di organi metastatizzati.
E' tra le forme neoplastiche più diffuse e rappresenta tra i tumori la prima causa di morte per le donne. Le età a rischio sono tra i 45 e 55 anni e tra i 65 e i 75. La sua frequenza è massima nei paesi occidentali industrializzati.
I fattori di rischio riconosciuti sono:
Familiarità da parte materna: madre, sorelle, zie con neoplasia al seno.
Menarca precoce (prima dei 12 a.) e menopausa fisiologica tardiva (dopo i 55 a.)
Numero ridotto di gravidanze e limitato periodo di allattamento al seno.
Obesità con alimentazione ricca di grassi specie animali.
Presenza di mastopatia fibrocistica e iperplasia duttale atipica.
La neoplasia può originare dai lobuli o dai dotti della ghiandola (v. Figura).
Le forme istologiche principali sono:
Carcinoma intraduttale e carcinoma lobulare in situ, ambedue a bassa invasività.
Carcinoma duttale infiltrante ad elevata invasività.
Da segnalare la neoplasia di Paget con lesione iniziale retroareolare o sotto il capezzolo: altra forma particolare da citare è la lesione neoplastica che origina nei dotti precapezzolari dove il primo sintomo è rappresentato dal sanguinamento proveniente dal capezzolo.
Altri tipi istologici sono poco frequenti.
Il primo segno è la presenza di un nodulo nella regione mammaria, normalmente non dolente.
La diagnosi è posta con esame clinico, mammografia, ecografia della mammella, cito-istologia su agoaspirato mammario.
La terapia è sempre multidisciplinare con chirurgia, radioterapia, chemioterapia, ormonoterapia.
Anche se spesso non è possibile la guarigione, un adeguato trattamento combinato permette una lunga sopravvivenza con buona qualità di vita.
In fase avanzata può metastatizzare a quasi tutti gli organi in particolare ossa, polmone, fegato, encefalo, cute.
I fattori prognostici (previsione dell'andamento della malattia) dipendono in parte dalle dimensioni del tumore (almeno fino a T2) ma soprattutto dalla invasione dei linfonodi ascellari: maggiore è il numero dei linfonodi invasi minori sono le probabilità di successo.
Importante inoltre lo stato dei recettori ormonali presenti sul tessuto tumorale: in presenza di recettori per estrogeni (RE) e progestinici (RPr) la prognosi è migliore.
E’ fondamentale arrivare ad una diagnosi il più precoce possibile, in quanto oltre che avere una malattia localizzata è possibile effettuare un trattamento chirurgico il più conservativo possibile con risparmio della ghiandola (nodulectomia e quadrantectomia).
I tumori della mammella, qualsiasi sia il tipo istologico, rispondono bene sia alla radio sia alla chemioterapia.
La chirurgia può essere più o meno demolitiva in relazione allo stadio della malattia, in ogni caso, è necessario effettuare lo svuotamento ascellare linfonodale non tanto a scopo terapeutico, ma prevalentemente per motivi diagnostici e prognostici sui quali impostare la successiva terapia.
La radioterapia si impone negli interventi conservativi (nodulectomia e quadrantectomia) oppure nelle neoplasie in stadio avanzato o nelle multicentriche (vari foci neoplastici nel contesto della ghiandola).
La chemioterapia è adiuvante nelle condizioni a rischio. Quasi tutti i farmaci hanno dimostrato efficacia nel controllare la neoplasia, perciò esistono numerosi protocolli di polichemioterapia utilizzabili in varie linee.
Essendo il carcinoma mammario ormonodipendente, vengono utilizzati come terapia di mantenimento antiestrogeni, antiprogestinici, inibitori delle aromatasi, analoghi LH-RH.
Nelle pagine seguenti si riportano le raccomandazioni per un corretto trattamento terapeutico e le indicazioni di un corretto follow-up post-mastectomia.
Prevenzione: nessuna
Diagnosi precoce: autopalpazione del seno, screening mammografico nelle età a rischio o nelle donne con fattore di rischio elevato.
A causa della mutilazione che si impone è di solito necessario un supporto psicologico adeguato sia pre che post mastectomia.
Lo svuotamento ascellare può comportare ridotto ritorno linfatico con conseguente edema all’arto superiore per questo è indispensabile fornire alla mastectomizzata indicazioni precise di comportamento, quali movimento precoce dell’arto post mastectomia, ginnastica appropriata, eventualmente linfodrenaggio.
Sintomi prevalenti in fase avanzata: dipendono quasi esclusivamente dalle lesioni metastatiche e quindi dagli organi interessati.
Si riportano le conclusione del CONSENSUS CONFERENCE del 1994 sul follow up nelle pazienti con carcinoma della mammella.
Le donne curate per un carcinoma della mammella sono sempre più spesso da considerare guarite.
Per molte pazienti i controlli e gli accertamenti sono fonte di ansia, inoltre per la comunità il costo annuo è elevato per cui è necessario fare chiarezza sulla utilità dei controlli.
Il follow-up ha lo scopo di aumentare la sopravvivenza e di migliorarne la qualità, grazie ad una diagnosi anticipata dell'eventuale ripresa di malattia che potrà essere curata applicando terapie efficaci.
Allo stato attuale delle conoscenze scientifiche queste finalità vengono raggiunte per buona parte delle ricadute locali e per i tumori all'altra mammella. Non è ancora dimostrata la vera efficacia nel migliorare la prognosi per le metastasi a distanza.
Si conviene pertanto che l'elemento centrale del follow-up sia l'esame clinico approfondito. Si suggerisce un intervallo di tre mesi nei primi due anni dal trattamento primario, di sei mesi per altri tre anni e di dodici mesi in seguito.
L'unico esame strumentale di cui si consiglia l'esecuzione programmata è la mammografia che sarà annuale o biannuale in funzione del rischio della paziente.
Per tutti gli altri esami strumentali (Rx torace, ecografia epatica, scintigrafia ossea, ecc.) e di laboratorio, compresi i markers tumorali, si conviene non vengano utilizzati in follow-up prefissato ma prescritti di volta in volta in relazione dell'esame clinico.
In base alle indicazioni scientifiche, in un contesto di limitate disponibilità finanziare, è necessario privilegiare interventi diagnostici di comprovata efficacia clinica, deviando le risorse stesse per altri programmi nell'ambito della patologia mammaria.
I controlli periodici devono essere organizzati partendo dalla centralità della paziente, pertanto risulta essenziale:
-il diritto della paziente ad avere una figura di riferimento precisa che potrà essere il medico di famiglia, lo specialista o una equipe specialistica adeguatamente strutturata;
-il diritto della paziente a ricevere informazioni competenti, interdisciplinari, non contradditorie;
-il diritto della paziente alla facilità d'accesso alle prestazioni in termini di orari, tempi e semplicità dei percorsi burocratici.
Si ricorda che il miglioramento dei risultati clinici raggiunti dipenderà dagli sviluppi futuri della ricerca scientifica; questa, oltre al rispetto delle regole etiche e alla necessità del consenso informato, dovrà rispondere ad almeno tre esigenze fondamentali:
- accertare l'efficacia delle tecnologie diagnostiche e dei loro schemi di impiego nel follow-up;
- definire fattibilità ed efficacia di specifici interventi in follow-up di sottogruppi di pazienti a rischio differenziato di recidiva;
- sviluppare e valutare terapie più efficaci.
Questi obiettivi potranno essere raggiunti solo con studi controllati che coinvolgano un elevato numero di pazienti, avendo come indicatori principali la sopravvivenza globale e la qualità della vita.
TUMORI DELL'APPARATO GENITALE FEMMINILE
Comprendono i tumori della vagina, utero, ovaie.
Carcinomi della vagina: sono tutti di tipo squamoso, poco frequenti, prediligono l'età avanzata.
Perdite ematiche vaginali costituiscono il sintomo principale, il riscontro è quasi sempre casuale in corso di Pap-test. La terapia di elezione è costituita da infissione locale di aghi radioattivi (curieterapia). Nei casi avanzati si può tentare chirurgia altamente demolitiva seguita da radioterapia. Inutile la chemioterapia. La sopravvivenza è buona nei casi iniziali, pessima nelle forme invasive avanzate.
Carcinomi dell'utero: dobbiamo separare i carcinomi della cervice uterina (portio) da quelli del corpo dell'utero, avendo origini e comportamenti del tutto differenti.
Carcinomi della cervice uterina: prevalentemente sono del tipo squamoso. Nei paesi industrializzati, per merito dello screening di massa con Pap-test, sono in netta riduzione, ad esclusione delle donne anziane. I fattori di rischio sono la attività sessuale precoce specie con partners multipli, numerose gravidanze, scarsa igiene sessuale della donna e del partner. Altri fattori sono infezioni recidivanti da herpes simplex tipo 2 e da papilloma virus.
I sintomi sono modesti e aspecifici quali perdite ematiche vaginali, dolore durante i rapporti sessuali.
La diagnosi viene posta con citologia cervico-vaginale (Pap-test), colposcopia, biopsia di eventuali lesioni. La prognosi nei casi iniziali è favorevole specie nel carcinoma in situ dove la conizzazione può essere risolutiva.E' infausta nei casi avanzati anche se trattati con chirurgia altamente demolitiva. Spesso è utile il trattamento radiante. Poco efficace la chemioterapia.
Carcinoma del corpo dell'utero: si prendono in considerazione solo i carcinomi dell'endometrio, essendo i più frequenti. Istologicamente sono degli adenocarcinomi a bassa invasività e quindi a prognosi favorevole. I fattori di rischio riconosciuti sono età postmenopausale con picco tra 60-70 anni, obesità, diabete o altre disfunzioni endocrine compreso distiroidismo, nessuna gravidanza, menarca precoce e menopausa tardiva.
I sintomi ripropongono quelli già visti per le altre neoplasie genitali.
La diagnosi può essere casuale con Pap-test, quindi confermata con biopsia endometriale.
La terapia di elezione è chirurgica con isteroannessiectomia ed eventuale linfoadenectomia. A seconda dell'invasione, da valutare in sede operatoria, può essere seguita da radioterapia pelvica.
Negli stadi avanzati la chemioterapia si dimostra utile, così come l'ormonoterapia con progestinici. Negli stadi iniziali la sopravvivenza a 5 anni è del 100% per ridursi progressivamente negli stadi successivi
Tumori dell'ovaio: A causa della eterogeneità delle cellule presenti nell'ovaio si riconoscono vari tipi istologici; la forma epiteliale (carcinoma ovarico) è la più frequente.
I fattori di rischio sono assenza di gravidanze o prima gravidanza tardiva, menopausa tardiva, età superiore ai 40 anni (mentre le forme germinali prediligono la giovane età), aree industrializzate.
Il sintomo principale è l'aumento di volume dell'addome nella parte inferiore, possono coesistere dolori addominali aspecifici e lombosciatalgie ribelli al trattamento antiflogistico. La diagnosi è posta con ecografia pelvica. Frequentemente al primo riscontro la neoplasia è già di discrete dimensioni per cui anche l'esame ginecologico può indirizzare verso la diagnosi. Frequente la presenza di versamento ascitico. La diffusione peritoneale avviene precocemente tanto che nella stadiazione non è considerata metastasi. Può metastatizzare a fegato, polmoni.
La terapia è chirurgica seguita da chemioterapia aggressiva. Negli stadi avanzati utile far precedere all'intervento la chemioterapia per ridurre le masse.
Prevenzione: nessuna
Diagnosi precoce: Pap-test per cervice e utero; controlli ginecologici.
TUMORE DELLA PROSTATA
E' il tumore maschile più frequente tra i 60 e 70 anni e alla diagnosi si presenta in fase avanzata nel 35-40% dei casi. Istologicamente è un adenocarcinoma.
Vi è una correlazione, anche se non del tutto nota, con fattori ormonali (testosterone).
I sintomi principali sono minzionali: pollachiuria, nicturia, disuria.
Alla ispezione rettale si può repertare una prostata aumentata di volume o una asimmetria della ghiandola con consistenza aumentata. La diagnosi viene posta con agobiopsia transrettale, ecografia pelvica e transrettale, completata da TUR che molto spesso, nello stadio iniziale, diviene intervento risolutore. Metastatizza precocemente alle ossa con aspetti di addensamento della struttura (tipo blastico) al contrario delle altre neoplasie che hanno aspetto litico.
L'intervento chirurgico di prostatectomia con linfoadenectomia negli stadi iniziali garantisce la guarigione. La terapia di elezione, quando non vi è indicazione chirurgica, è il trattamento ormonale ablativo somministrando analoghi dell'LH-RH associati a farmaci antiandrogeni. Utile anche se poco usata la somministrazione di estrogeni a scopo palliativo quando termina la risposta al trattamento ormonale ablativo.
La progressione delle metastasi ossee, quando la malattia diviene refrattaria al trattamento ormonale, trae beneficio dalla radioterapia palliativa oppure dalla somministrazione di stronzio radioattivo per via sistemica (e.v.).
Se ben trattato il carcinoma prostatico permette una lunga sopravvivenza con discreta qualità di vita (sopravvivenza a 10 anni di circa il 50%).
Ovviamente i risultati sono ottimi quando la diagnosi è posta con tumori in stadio T1-T2, per cui è importante una diagnosi precoce; è raccomandabile, quindi, che i maschi al di sopra dei 50 anni si sottopongano regolarmente al controllo urologico.
Si segnala che per il carcinoma prostatico risulta di grande validità il marker tumorale PSA sierico (Antigene Prostatico Specifico) che se alterato, indica con buone probabilità la presenza del tumore.
Prevenzione: nessuna
Diagnosi precoce: controllo urologico annuale dopo i 50 anni. Ricerca del PSA nel sangue.
A completamento si riportano le conclusioni del Consensus Conference sul ruolo del follow-up nella qualità di vita del paziente con carcinoma prostatico avanzato del 1994.
Nonostante si ritenga che:
1°) la terapia ormonale nel carcinoma prostatico in fase avanzata non sia curativa ma palliativa,
2°) un inizio precoce del trattamento ormonale riduca la qualità di vita legata alla perdita assoluta della potenza sessuale e alla tossicità degli antiandrogeni,
3°) l'impiego degli antiandrogeni riduca l'inibizione competitiva della crescita neoplastica tra cellule ormono-sensibili e cellule ormono-resistenti con crescita più accelerata delle seconde,
i partecipanti al Conference sono d'accordo nell'impiego precoce della deprivazione androgenica subito dopo la diagnosi di carcinoma prostatico avanzato, ritenendo che i benefici che si ottengono sulla storia naturale della malattia in termini di sopravvivenza e di qualità di vita, siano più importanti della potenza sessuale o del rischio di tossicità.
Per quanto riguarda il follow-up più o meno assiduo, si conviene che controlli ravvicinati sono meglio accettati dal paziente che si sente rassicurato dallo stretto rapporto medico-paziente, inoltre una eventuale progressione di malattia potrà essere diagnosticata precocemente.
Anche se non è stato dimostrato che la precocità della rilevazione di progressione possa avere un impatto positivo sulla durata della vita, se ne può migliorare la qualità intervenendo sul dolore e sulle eventuali complicanze quali l'ostruzione delle vie urinarie.
In linea di massima in paziente portatore di carcinoma prostatico asintomatico in trattamento ormonale è consigliabile effettuare un dosaggio del PSA ogni 3 mesi con relativo colloquio medico, ulteriori accertamenti potranno essere effettuati solo se si verifica un incremento del marker.
Comprendono i tumori della vescica e del rene. Anche se rari, possono originare dagli ureteri e dalla uretra. Saranno considerati solo i primi due.
Carcinoma della vescica: è la forma più frequente del tratto urinario. Predilige i maschi (rapporto M/F circa 3/1) tra i 50 e 70 anni. Si riconoscono vari agenti cancerogeni quali coloranti dell'anilina, derivati dei petroli e composti organici aromatici. Frequente nei paesi dove si riscontrano infestazioni croniche di bilharzia e schistosoma.
Si possono riconoscere forme superficiali e circoscritte con le caratteristiche del carcinoma in situ, oppure forme diffuse multicentriche (numerose zone affette da cancro iniziate in modo autonomo), altamente invasive.
Il tipo istologico è il tumore a cellule di transizione (istologica particolare che si rifà al tipo specifico delle cellule della mucosa vescicale).
La macroematuria improvvisa, che poi smette per ripresentarsi anche a distanza di tempo, è il sintomo principale; può coesistere disuria, stranguria e pollachiuria.
La diagnosi viene posta con citologia delle urine confermata da cistoscopia e relativa biopsia e dalla urografia per completare la stadiazione. Dopo invasione dei tessuti vescicali (mucosa, sottomucosa, muscolare, sierosa) può metastatizzare a distanza (polmoni, ossa).
La terapia nelle forme superficiali consiste nella TUR (Resezione Trans Uretrale) a cui possono fare seguito instillazioni endovescicali di antiblastici. Nelle forme invasive è indicata la cistectomia radicale con confezionamento di neovesciche o posizionamento di cateteri ureterali transcutanei.
L'intervento può essere completato da ciclo di radioterapia.
Nelle forme metastatizzate si può prolungare la sopravvivenza utilizzando la chemioterapia.
Carcinoma renale: detto anche ipernefroma. Frequente nei maschi intorno ai 50 anni.
Non si riconoscono fattori di rischio anche se di volta in volta sono stati presi in considerazione calcolosi renale, tabacco, abuso di estrogeni senza conferma della correlazione.
I sintomi sono macro-microematuria e dolori in regione lombare; certo che quasi sempre al momento della diagnosi si repertano masse di discrete dimensioni con invasione dei vasi renali da parte di emboli neoplastici oltre che metastasi polmonari. Altri siti di colonizzazione sono ossa, linfonodi, surreni.
La diagnosi si avvale di ecografia, TAC, urografia, angiografia renale, agobiopsia guidata sotto TAC.
Per gli stadi T1-3 è indicata la nefrectomia. Nello stadio T4 utile la nefrectomia palliativa seguita da chemioterapia o interferon o interleuchina-2. Nella palliazione si ottengono discreti risultati sia sulla sopravvivenza che nella qualità di vita con l'uso di progestinici ad alte dosi.
La radioterapia in questo caso non trova indicazioni.
Prevenzione: nessuna
Diagnosi precoce:
Vescica: controlli clinici in caso di macroematuria, controlli per microematuria.
Rene: nessuna.
PARTE TERZA
SISTEMA IMMUNITARIO
Da qualche anno la chemioterapia per il trattamento dei tumori ha tratto notevole vantaggio dall'impiego di farmaci adiuvanti che, stimolando la mielopoiesi riducono la depressione midollare, permettendo di aumentare sia la posologia che il numero di cicli della terapia antiblastica. Ciò si deve ai risultati ottenuti dalla ricerca sul sistema immunitario con la scoperta di nuovi fattori che modulano la risposta immunitaria stessa.
Il sistema immunitario è preposto alla difesa dell'organismo. Ha la funzione di distruggere o neutralizzare microorganismi quali batteri, funghi, virus oppure cellule provenienti da altri organismi (trapianto) o comunque qualsiasi sostanza che viene considerata estranea al corpo, comprese le cellule tumorali.
Il sistema immunitario comprende:
L'immunità aspecifica o innata, è un insieme di meccanismi di protezione naturale che si instaurano immediatamente al primo contatto con sostanze o organismi estranei. Il fenomeno più rappresentativo è la fagocitosi, per cui una volta accertata la loro estraneità, gli elementi vengono inglobati da cellule particolari ed eliminati.
L'immunità specifica, molto selettiva, si basa sulla produzione di anticorpi capaci di distinguere piccole variazioni strutturali di sostanze estranee (antigeni) e distruggerli, oppure la distruzione di corpi cellulari attraverso l'azione di cellule aventi anticorpi specifici di membrana. Ha efficacia dopo alcuni giorni dalla infezione, tempo necessario per riconoscere l'antigene e sviluppare le difese specifiche.
Per un risultato ottimale, i due sistemi interagiscono tra di loro.
Prima di entrare nel merito della immunità si riassume, nella tavola seguente, la emopoiesi.
Le cellule pluripotenti midollari si differenziano in due famiglie: cellule staminali linfoidi e mieloidi. Dalla prima originano i linfociti e dalla seconda originano gli eritrociti, i granulociti, i monociti e i megacariociti.
Si evidenzia come le cellule presenti nel sangue periferico denominate Natural Killer siano state inserite nella famiglia linfocitaria per similitudine di morfologia e funzione, anche se in effetti la loro origine non è ancora nota.
Tra i CFU e gli elementi periferici maturi, vi sono le varie cellule immature delle corrispondenti serie.
Gli elementi preposti alla immunità aspecifica sono i granulociti polimorfonucleati (neutrofili, eosinofili, basofili) e i monociti.
I granulociti neutrofili ed eosinofili esplicano la loro attività attraverso la fagocitosi, i primi per batteri e i secondi per parassiti; gli eosinofili inoltre aumentano considerevolmente nelle allergie aspecifiche.
I granulociti basofili, la cui funzione non è ancora ben nota, prendono parte alle reazioni allergico-anafilattiche liberando istamina, di cui sono produttori.
I monociti, sempre di origine midollare ma con nucleo compatto (non granulocita), uscendo dalla corrente ematica penetrano nei tessuti circostanti, aumentano di dimensioni diventando grandi cellule dette macrofagi. Sia i monociti che i macrofagi hanno attività fagocitaria.
Inoltre, nei tessuti (fegato, milza, linfonodi, ecc.), riconosciamo cellule aspecifiche fagocitarie denominate cellule reticolo-endoteliali.
Alla immunità aspecifica partecipa anche la famiglia di linfociti non-B e non-T, le cellule Natural Killer (NK), che distruggono cellule neoplastiche e cellule infettate da virus.
Le cellule preposte alla immunità specifica sono i linfociti che derivano dalle cellule staminali pluripotenti localizzate nel midollo osseo emopoietico dell'adulto (nell'embrione la sua sede è l'angioblasto, nel feto è il fegato).Queste cellule per poter divenire attive, devono migrare in organi linfatici centrali o organi linfoepiteliali che sono gli organi borsa-equivalenti (il termine ha origine dalla prima osservazione fatta sugli uccelli dove questo organo corrisponde alla Borsa di Fabrizio) e il timo.
Nell'uomo l'organo borsa-equivalente è il midollo emopoietico, che si può immaginare perciò diviso in due settori, uno contenente le cellule staminali e l'altro che esercita la funzione della Borsa di Fabrizio.
I linfociti pertanto si divideranno in due popolazioni simili per morfologia, numero e massa:
i linfociti B ( da Bone marrow) attivati dall'organo borsa-equivalente e i linfociti T attivati dal Timo.
Linfociti B: Sono preposti alla immunità umorale. Dopo la loro differenziazione negli organi borsali si specializzano nella produzione di anticorpi.
I linfociti B circolano continuamente fra sangue, linfa, linfonodi, milza senza rientrare negli organi centrali. In presenza di antigeni e dopo il loro riconoscimento, si trasformano in plasmacellule che producono molecole proteiche specifiche per neutralizzare ed eliminare l'antigene stesso: gli anticorpi.
I linfociti B devono la loro specificità alla presenza, sulla loro membrana cellulare, di recettori capaci di riconoscere un antigene specifico e produrre il relativo anticorpo.
Gruppi di linfociti geneticamente identici, provenienti da una unica cellula progenitrice e quindi con recettori uguali, rappresentano un clono di cellule. Il clono, riconosciuto l'antigene e sotto l'azione di fattori di crescita, ha la possibilità di espandersi, producendo grandi quantità di anticorpi necessari alla neutralizzazione degli antigeni stessi.
Si calcola che gli antigeni esistenti al mondo siano 10.000.000 e che un clono specifico per ogni antigene sia formato da 10.000 linfociti B. Ogni clono, quando necessario, si espanderà aumentando il numero delle cellule che verranno in parte trasformate in plasmacellule atte a produrre anticorpi e in piccola parte costituirà la memoria immunologica del clono linfocitario.
Il risultato di ciò sarà una maggior rapidità nel produrre anticorpi quando lo stesso antigene si ripresenterà una seconda volta.
La produzione di anticorpi necessita della collaborazione di altre cellule del sistema immunitario come i macrofagi e alcuni tipi di linfociti T, oltre a fattori umorali ematici quali le citochine (vedi), i fattori di crescita e il complesso di istocompatibilità HLA.
Linfociti T: Sono preposti alla immunità cellulare. Derivano dalle cellule staminali midollari che migrano e si differenziano nel timo. Una volta fuoriusciti si mescolano ai linfociti B e circolano come questi negli organi periferici senza mai rientrare negli organi linfatici centrali.
Esistono quattro sottopopolazioni di linfociti T:
linfociti TC cytotoxic (citotossici)
linfociti TH helper (ausiliari)
linfociti TS suppressor (soppressori)
linfociti TDH delayed hypersensitivity (della ipersensibilità ritardata)
I linfociti citotossici hanno la funzione del rigetto di trapianti tra tessuti eterologhi e delle cellule tumorali o comunque di tutte le cellule e tessuti non riconosciuti come parte dell'organismo.
I linfociti helper e i suppressor hanno azione regolatrice sui citotossici.
I linfociti DH (della ipersensibilità ritardata) agiscono stimolando i macrofagi e, aumentando la permeabilità vascolare, determinano un processo infiammatorio avente lo scopo di allontanare gli antigeni. Questo processo avviene in un tempo successivo relativamente lungo rispetto al contatto con l'antigene.
Tutti i linfociti presentano sulla membrana cellulare delle proteine specifiche denominate marcatori di membrana, variabili sia nei riguardi della funzione del linfocita ma soprattutto del suo grado di maturazione. Vengono denominati marcatori CD seguiti da un numero. Tra i più rappresentativi si ricordano i marcatori CD4 e CD8 su linfociti T helper e citotossici perchè la loro quantità è il fattore predittivo principale nella infezione da HIV e la sua successiva progressione in AIDS.
A titolo di esempio riportiamo uno schema di azione dei linfociti T:
Quando un antigene penetra nell'organismo, viene captato da un macrofago per pinocitosi e processato, cioè reso riconoscibile ai linfociti. I macrofagi presentano delle molecole proteiche di superficie denominate di classe I riconosciute dai linfociti T Citotossici e di classe II riconosciute dai linfociti T Helper.
I linfociti TH si legano contemporaneamente alla molecola di classe II e all'antigene processato, vengono attivati da una citochina, Interleukina 1 (IL 1), prodotta dal macrofago presentante l'antigene stesso, che agendo come fattore di crescita espande il clono linfocitario. Il linfocita TH attivato produce la interleukina 2 (IL 2).
I linfociti TC, a loro volta, si legano alla molecola di classe I e all'antigene processato e sotto lo stimolo della interleukina 2, si espandono e neutralizzano gli antigeni estranei.
Il processo è destinato a durare fintanto che i linfociti T helper producono interlekina 2.
Quando la quantità di linfociti TC è considerevole, viene stimolata la produzione di linfociti soppressori (TS) che bloccando la produzione di interleukina 2, limitano l'espansione del clono linfocitario citotossico (quest'ultimo passaggio non è rappresentato nello schema).
Con il termine di citochine si intende un ampio numero di molecole, prodotte dalle cellule preposte alla immunità, dotate di proprietà regolatrici sulla immunità stessa. A seconda della loro funzione vengono classificate in interleuchine, fattori stimolanti la crescita cellulare, interferoni.
Nonostante le differenze strutturali e funzionali sono tutte delle proteine glicosilate (glicoproteine) a basso peso molecolare, aventi elevata affinità per i recettori di membrana cellulare ed elevata potenza di azione. Diamo un cenno alle principali citochine:
Interleuchine (IL): La prima interleuchina è stata scoperta nel 1972 e da allora la ricerca ha evidenziato un numero elevatissimo di queste sostanze con azione a volte simili e a volte molto differenti, ma tutte influenzanti la risposta immunologica. Tra le principali ricordiamo:
IL1 InterLeuchina 1: è prodotta dai macrofagi ed è essenziale per la proliferazione di tutti i linfociti T. Può indurre inoltre la secrezione di IL2; sembra che attivi anche i polimorfonucleati.
IL2 InterLeuchina 2: è stata la prima interleuchina scoperta nel 1972. E' prodotta prevalentemente dai linfociti T helper attivati. Agisce come un fattore di crescita, inducendo sia la proliferazione che la differenziazione dei linfociti B. Inoltre stimola tutte le sottopopolazione di linfociti T dopo la loro attivazione.
IL3 InterLeuchina 3: prodotta dai linfociti T helper attivati e dai monociti, agisce come fattore di crescita sulle cellule emopoietiche.
IL6 InterLeuchine 6: prodotta dai monociti, fibroblasti, cellule endoteliali. Sembra che agisca come fattore di crescita sulle plasmacellule trasformandole patologicamente in plasmocitoma.
Fattori stimolanti la crescita cellulare CSF o fattori di crescita: Appartengono anch'essi al gruppo delle citochine ed è dimostrata la loro azione di stimolo a livello midollare, quindi azione analoga alle interleukine, ma più rapida e intensa.
S-CSF (Stromale-Colony Stimulating Factor): viene prodotto dalle cellule stromali del midollo osseo ed agisce come fattore di crescita sui precursori emopoietici.
G-CSF (Granulocyte - Colony Stimulating Factor):viene prodotto da monociti, fibroblasti, cellule endoteliali. Agisce sui polimorfonucleati (specialmente i granulociti) e sui monociti incrementando la mielopoiesi.
GM-CSF (Granulocyte Macrophage - Colony Stimulating Factor): viene prodotto dai linfociti T, dai monociti, dai fibroblasti, dalle cellule endoteliali, dagli osteoblasti. Agisce sui precursori mieloidi ed eritroidi, sui polimorfonucleati, sui monociti, sulle cellule endoteliali come fattore di crescita e differenziazione. La sua azione è particolarmente attiva sui monociti e sui granulociti.
M-CSF (Macrophage - Colony Stimulating Factor): origina da monociti, fibroblasti, cellule endoteliali. Le cellule bersaglio sono i monociti che sotto il suo stimolo aumentano considerevolmente la produzione.
I fattori G, GM-CSF sono prodotti industrialmente e utilizzati come farmaci adiuvanti nella chemioterapia per ridurre la leucopenia iatrogena.
Diamo un elenco con alcuni nomi commerciali:
fattore crescita nome chimico nome commerciale
G-CSF filgastrim GRANULOKINE-NEUPOGEN
G-CSF lenograstim MYELOSTIM
GM-CSF sargramostim LEUKINE-PROKINE
GM-CSF molgramostim LEUCOMAX-MIELOGEN
Tra i fattori di crescita riteniamo utile inserire la ERITROPOIETINA sebbene non sia di origine midollare o prodotta da cellule del sistema immunitario; infatti è un ormone di origine prevalentemente renale (circa il 10-15% è prodotto nel fegato) e agisce specificatamente sulla serie eritroide e megacariocitica aumentando la produzione di globuli rossi e in minor misura delle piastrine.
INTERFERONE (IFN)
La scoperta dell'interferone risale al 1957, ma solo negli anni 80 è stata fatta piena luce sulla sua struttura e attività.
Con il termine di interferone si raggruppano almeno tre molecole glicoproteiche con attività prevalentemente antivirale ma anche anticellulare e antitumorale: gli interferoni alfa, beta e gamma. .
Interferone alfa è sintetizzato da monociti, macrocrofagi, linfociti B stimolati da particelle virali, ma anche da RNA estranei, prodotti microbici, polimeri organici e cellule eterologhe. Fino ad ora sono stati isolati più di 20 sottotipi (dovuti a variazioni nella molecola proteica).
Interferone beta è prodotto da fibroblasti stimolati da virus
Interferone gamma prodotto dai linfociti T stimolati da antigeni specifici.
Gli interferoni, una volta sintetizzati, proteggono da qualsiasi virus e non dalla famiglia che ha stimolato la sua sintesi, cioè sono virus-aspecifici. Presentano però specificità per la specie, così, ad esempio, un interferone di topo protegge solo il topo e un interferone umano protegge solo l'uomo, quindi la produzione farmaceutica degli interferoni deve utilizzare solo cellule umane.
Il meccanismo d'azione è indiretto nel senso che l'interferone non inibisce l'azione del virus, ma agendo sulla sintesi proteica delle cellule, induce la sintesi di proteine effettrici che aumentano la resistenza cellulare all'azione di tutti i virus.
Semplifichiamo il meccanismo d'azione con il seguente schema:
L'induttore, che può essere un agente virale o delle cellule estranee (esempio cellule neoplastiche) o altri antigeni, agisce (A) sul DNA della cellula produttrice di interferone (monociti, macrofagi, linfociti B o T, ecc) inducendo la produzione dell'interferone (IFN) stesso, questi, a sua volta agisce su un altro settore del DNA cellulare inducendo la produzione delle proteine effettrici (PE) aventi la funzione di aumentare la resistenza cellulare all'azione dei virus. L'interferone agirà su tutte le cellule (B) con le quali viene a contatto (cellule attivate). Attraverso un meccanismo ancora sconosciuto le cellule attivate riescono a trasferire la capacità di produrre proteine effettrici per semplice contatto alle cellule vicine (C).
Le indicazioni terapeutiche accertate dell’interferon sono le epatite croniche attive, leucemie a cellule capellute, sarcoma di Kaposi, linfomi non Hodgkin, carcinoma renale e in casi selezionati nel melanoma e nel mieloma multiplo.
Si segnala l'uso del farmaco intracavitario a scopo palliativo per ridurre versamenti pleurici ed ascitici recidivanti.
Riportiamo i principali prodotti commerciali:
Interferone a - 2a ROFERON-A
Interferone a - 2b INTRON-A
Interferone a n-1 HUMOFERON, WELLFERON
Interferone a n-3 ALFAFERONE, BIAFERONE, CILFERON-A, HAIMAFERONE, ISIFERONE
Interferone b BETANTRONE, FRONE, NAFERON
Si è più volte sottolineato che la possibilità di guarigione dalle neoplasie è legata alla diagnosi precoce. Ciò potrebbe essere possibile con campagne di screening su tutta la popolazione se vi fosse la possibilità di impiegare esami semplici, a basso costo, sensibili e specifici per ogni tipo di tumore.
Una delle strade intraprese da anni dai ricercatori è la determinazione, attraverso un semplice prelievo venoso, di sostanze di origine tumorale presenti nel sangue: i markers o marcatori tumorali.
Per markers tumorali si intendono tutte quelle sostanze qualitativamente o quantitativamente rilevabili nel sangue, per le quali è dimostrabile una correlazione con le neoplasie maligne.
I markers possono essere prodotti direttamente dalle cellule neoplastiche o possono corrispondere a variazioni bioumorali secondarie all'attività del tumore nell'ospite.
Ai marcatori è richiesto di evidenziare differenze tra individuo sano e neoplastico oltre che evidenziare le caratteristiche biologiche del tumore.
Un marker ideale dovrebbe presentare le seguenti caratteristiche:
1) essere presente in quantità adeguata nella fase preclinica della malattia.
2) essere presente in tutti i soggetti malati e assente in tutti i soggetti sani.
3) essere specifico per ogni tipo di neoplasia, quindi dalla sua presenza è possibile risalire all'organo interessato.
4) presentare correlazione tra stadio della malattia e quantità di markers rilevabile.
Per il momento nessuno dei markers in uso soddisfa, in tutto o in parte, questi criteri per cui la loro valutazione può essere solo quantitativa e i valori ottenuti devono essere interpretati secondo le leggi statistiche e non matematiche.
Assume particolare significato il concetto probabilistico della sensibilità e della specificità.
Sensibilità: definisce la probabilità che un marker sia positivo in presenza di un determinato tumore. In pratica il marker ideale dovrebbe essere presente (positivo) in tutti i portatori di un tipo particolare di tumore. Non essendo questo possibile la sensibilità è data dal rapporto:
numero dei risultati veri positivi
sensibilità = ---------------------------------------------- x 100
totale degli ammalati
Specificità: definisce la probabilità che un marker sia negativo in assenza di un determinato tumore. Il marker ideale dovrebbe essere sempre assente (negativo) in una persona sana o comunque non affetta da un dato tipo di tumore.
Si ottiene dal rapporto:
numero dei risultati veri negativi
specificità = ---------------------------------------------- x 100
totale dei sani
La situazione teorica corrisponde quindi a valori di sensibilità e di specificità uguali al 100%, situazione che attualmente è ben lungi dall'essere ottenuta con qualsiasi tipo di marcatore.
Infatti a causa della difformità e della complessità della biologia dei tumori, non sempre questi producono il marker, oppure lo producono in quantità mal valutabile con le attuali tecniche di laboratorio, per cui nei riguardi della sensibilità i portatori di questo tipo di neoplasia risulterebbero sani (falsi negativi).
Al contrario, valutando la specificità si possono riscontrare persone sane che, per svariati motivi, risultano possedere nel sangue piccole quantità del marker, oppure pazienti portatori di patologia non neoplastica che producono il marker, per cui risultano portatori di un tumore (falsi positivi).
In parte si è superato questo problema determinando statisticamente un valore soglia massimo di patogenicità (cut off) per cui si ritiene che al di sotto del "cut off" la persona sia sana, al di sopra affetta da tumore. All'intorno del cut off esiste una zona più o meno ampia di dubbio diagnostico o borderline per cui non si ha la possibilità di porre un giudizio decisivo.
Ad esempio nel caso del CEA, per i pazienti non fumatori, si considera un cut off di 10 ng/ml; al di sopra di questo valore vi è la "certezza" della presenza di una neoplasia, al di sotto di 10 fino a 4,6 ng/ml possiamo ipotizzare malattie benigne oppure maligne in fase iniziale, al di sotto di 4,6 ng/ml possiamo "considerare" la persona sana. Tutto ciò nel rispetto di valutazioni statistiche e quindi valide per i grandi numeri e non per un singolo caso.
Se in un diagramma riportiamo la specificità e la sensibilità in valori percentuali relativa ad un marker, otteniamo una curva (curva ROC - Receiver Operating Characteristics) che ci consente una buona valutazione sul suo valore diagnostico.
Riportiamo come esempio un ROC per i markers CA 15-3, MCA, CEA impiegati per il cancro mammario.
Nelle ascisse riportiamo la specificità percentuale dei markers determinata in vari gruppi di pazienti sani, nelle ordinate la sensibilità percentuale determinata in vari gruppi di persone sicuramente ammalate di cancro. Se la determinazione dei markers fosse certa la curva coinciderebbe con gli assi (100% in ambedue i casi), sapendo che non è così immaginiamo una curva ideale molto vicina a questi (pari a circa il 95%).
Nella realtà osserviamo che per il CA15-3 la curva si approssima a quella ideale, mentre il CEA è molto lontano, la conclusione è che per il cancro della mammella la scelta del marker CA15-3 dà migliori garanzie del CEA che si dimostra poco specifico e poco sensibile. Per il marker MCA rileviamo valori intermedi tra i due.
Si fa presente che il diagramma non riporta valori inferiori al 50% perchè l'esame al di sotto di questa percentuale sarebbe inutile, in quanto gli errori sarebbero superiori ai risultati.
La determinazione contemporanea di più markers permette di migliorare le possibilità diagnostiche.
I markers possono originare:
1) dal nucleo cellulare (ad esempio oncògeni presenti nel DNA) rilevabili con tecniche citoistologiche e di biologia molecolare che esulano dal nostro argomento.
2) dal citoplasma cellulare e relativo metabolismo (come enzimi, ormoni, antigeni oncofetali, ecc).
3) dalla membrana cellulare (ad esempio antigeni di membrana tumore associati, glicoproteine, fibronectina, ecc.).
Tratteremo i markers dei punti 2-3) perchè i soli ad essere presenti nel sangue.
Da un punto di visto clinico non esiste una vera e propria classificazione in quanto le sostanze che vengono utilizzate come marcatori sono di origine e natura eterogenea, in ogni caso proponiamo la classificazione che attualmente trova maggiori consensi.
A) Antigeni tumori-associati:
1) sostanze biochimiche note, identificate mediante antisieri anti-tumore:
CEA antigene carcino embrionale
AFP alfa feto proteina
TPA antigene polipeptidico tissutale
PSA antigene prostatico specifico
SCC antigene del carcinoma squamoso.
2) marcatori mucinici identificati da anticorpi monoclonali.
B) Ormoni: a sede eutopica provenienti da una ghiandola ipersecernente per trasformazione neoplastica (es.insulina, glucagone, catecolamine, prolattina), oppure a sede ectopica quando un tumore in un organo specifico produce un ormone che normalmente non dovrebbe esserci, ad esempio gonadotropina corionica, presente in gravidanza, prodotta da un tumore del testicolo o dell'ovaio.
C) Enzimi prodotti in quantità non fisiologica, ad esempio elevatissimi valori di fosfatasi alcalina nelle metastasi ossee o epatiche.
D) Vari: prodotti aspecifici del normale metabolismo secreti in quantità abnorme, ad esempio elevati livelli idrossiprolina, rame, calcio, ecc. o anomalie dei normali parametri umorali ad esempio aumento considerevole della VES, PCR, ecc.
Diamo una descrizione dei principali markers utilizzati attualmente:
Alfa feto proteina AFP: e' una glicoproteina molto simile ad una albumina prodotta nel periodo fetale dal fegato e dal tratto gastrointestinale con funzioni di trasporto per gli estrogeni e i grassi non esterificati, molecole indispensabili per le strutture cellulari ed il metabolismo energetico di cellule in attiva crescita. La quantità presente nel sangue dell'adulto è trascurabile. Il suo aumento in caso di neoplasie sembra sia correlato al fatto che alcune cellule neoplastiche non sono in grado di sintetizzare alcuni tipi di acidi grassi, per cui devono utilizzare le corrispondenti sostanze esogene che necessitano delle albumine carrier. Si segnala che nel periodo fetale l'AFP passa nel sangue materno per cui in gravidanza il suo riscontro rientra nella normalità ed è usato come test di valutazione di normalità del feto.
Si considerano valori normali quelli al di sotto di 7 IU/ml.
Si ritrova in elevate quantità nel carcinoma primitivo del fegato (anche superiore a 1200 IU/ml).
Con valori inferiori a 350-400 IU/ml può indicare inoltre neoplasia delle cellule germinali, dello stomaco, delle vie biliari, del pancreas e l'adenocarcinoma bronchiale.
Valori borderline sono presenti in tutte le epatopatie acute e croniche.
Antigene carcino embrionario CEA: E' prodotto in quantità elevata nel periodo embriono-fetale nel tratto gastrointestinale e nel pancreas. Partecipa ai processi di differenziazione e di regolazione cellulare. Nell'adulto continua ad essere presente nel sangue in piccole quantità (più elevate nei fumatori). Aumenta considerevolmente in presenza di adenocarcinomi in quanto la trasformazione neoplastica delle cellule rimette in causa la perdita dei meccanismi di regolazione e controllo dei processi differenziativi per cui il CEA ritorna ad essere prodotto in quantità elevate.
Si riscontra in caso di adenocarcinoma del colon-retto, dello stomaco, del pancreas, della mammella, del fegato, della tiroide e del polmone. Inoltre un suo aumento si evidenzia in caso di metastasi epatiche, polmonari, ossee.
Valori normali sono compresi tra 0-4,6 ng/ml per i non fumatori;
Valori dubbi compresi tra 4,6-10 ng/ml;
Valori patologici superiori a 10 ng/ml.
Si possono riscontrare aumenti entro il valore di 10 ng/ml nelle epatopatie alcooliche, nella cirrosi, nelle pancreatiti, nelle flogosi croniche del tratto gastrointestinale e polmonare.
Antigene polipeptidico tissutale TPA: Viene liberato nel sangue da cellule epiteliali in attiva divisione mitotica, pertanto è aumentato nei processi proliferativi sia neoplastici che flogistici. Si riscontra in quasi tutti i carcinomi e adenocarcinomi (gastrointestinali, genitourinari, polmone, mammella, tiroide) ma anche, sebbene in quantità più bassa, nelle epatiti e cirrosi epatiche, nelle infezioni delle vie aeree e urinarie ecc. Il cut off è posto a 80 U/ml.
Antigene prostatico specifico PSA: Anche se viene considerato un antigene associato al carcinoma prostatico in effetti è un enzima prodotto dalla prostata con lo scopo di fluidificare il liquido seminale; normalmente è presente in elevate quantità nel liquido prostatico e quasi assente nel siero. A causa del sovvertimento della struttura prostatica affetta da neoplasia passa nel sangue. E' specifico per l'iperplasia e per il carcinoma prostatico (a seconda della sua concentrazione ematica).
Il cut off normale è posto a 4 ng/ml, da 4 a 20 ng/ml possiamo avere o iperplasia o neoplasia iniziale, quando il valore è superiore a 20 ng/ml si può porre diagnosi di neoplasia. Attualmente è considerato l'unico marker da utilizzare nello screening diagnostico oncologico.
Antigene del carcinoma squamoso SCC o antigene TA-4: E' associato alle neoplasie dell'epitelio squamoso in particolare al carcinoma della portio. E' aumentato anche nei tumori squamosi del capo-collo, esofago e polmone.
Sono delle glicoproteine ad elevato peso molecolare componenti normali delle secrezioni ghiandolari di tipo mucinoso.
Nei soggetti sani sono presenti nel sangue in piccola quantità non riuscendo ad attraversare le strutture epiteliali integre. Attraverso i processi di trasformazione neoplastica degli epiteli ghiandolari viene favorito il passaggio nel sangue di grandi quantità di mucine.
La loro identificazione è possibile grazie agli anticorpi monoclonali.
Anche se alcuni antigeni sono associati a particolari tumori epiteliali, la loro presenza può essere accertata in istotipi differenti, per cui esiste solo una correlazione preferenziale per un dato tumore.
Ricordiamo CA 19.9, CA 15.3, CA 195, MCA, CA 125, CA 549, CA 50, TAG 72.3
(La sigla CA sta per Carbohidrate Antigen mentre i numeri che la accompagnano si riferiscono alla numerazione del clono cellulare scelto per la sua evidenziazione: ad esempio l'antigene CA 19-9 si rileva con l'anticorpo 116-ns-19-9).
Carbohidrate Antigen CA 19-9 o gastrointestinale: è presente nell'epitelio fetale del colon, intestino tenue, stomaco, pancreas, fegato. La presenza nell'adulto è indicativa per le neoplasie del pancreas, colon-retto, stomaco, vie biliari; meno specifico per fegato, bronchi, ovaio di tipo muccinoso, utero e mammella. Cut off 37 U/ml.
Valori borde line si riscontrano nelle cirrosi e altre epatopatie croniche, nelle pancreatiti acute e croniche e nella patologia benigna delle vie biliari.
Carbohidrate Antigen CA 15-3 o mammario: è presente nelle cellule degli epiteli ghiandolari secretori. Viene usato per il carcinoma mammario, sostituendo per la sua specificità il CEA. Valori aumentati si riscontrano anche nei tumori del polmone, del tratto gastrointestinale, della prostata, delle ovaie della portio uterina. Il CA 15-3 non risulta alterato nelle patologie benigne della mammella. Cut off inferiore a 27 U/ml
Mucin like Cancer Antigen MCA : é indicato per il tumore alla mammella anche se con una sensibilità e specificità inferiore del CA 15-3.
Carbohidrate Antigen CA 125 o ovarico: Valori elevati si presentano nel carcinoma ovarico, nonostante nel periodo fetale sia presente negli epiteli di tutto l'albero respiratorio. Valori aumentati si registrano anche per i tumori della portio e corpo dell'utero, carcinomi gastrointestinali e mammella anche se con scadente sensibilità. Valori elevati si riscontrano nella endometriosi e cisti ovariche benigne. Cut off inferiore a 35 U/ml.
Tumor Associated Glicoprotheine TAG 72-3: Valori elevati si riscontrano nel carcinoma gastrico dove viene utilizzato, nei tumori epatici, ovarici e nel microcitoma polmonare.
Anche se i prodotti di questa classe vengono utilizzati come marker si tratta di sostanze comunemente ricercate e determinate nel siero che per il loro valore abnorme indirizzano verso patologie neoplastiche. Si cita ad esempio un valore della VES superiore a 100, oppure ipoglicemie con elevatissimi livelli di insulina circolante che possono far pensare ad un insulinoma secernente. Anche livelli elevati di enzimi possono indirizzare verso una diagnosi neoplastica.
A quanto detto fanno eccezione alcuni ormoni ectopici, ad esempio ACTH nelle neoplasie polmonari o HCG nei seminomi e tumori ovarici in donne non gravide.
Non si ritiene opportuno trattare in modo dettagliato queste sostanze in quanto fanno parte della normale clinica di laboratorio e devono essere interpretati associandoli ad altri reperti clinici.
Attualmente la ricerca di nuovi markers più sensibili e più specifici è assai vivace; certo che riuscire con un semplice prelievo venoso a localizzare in un organo un tumore in fase iniziale contribuirebbe notevolmente alla soluzione del "problema cancro".
momento dell'impiego |
considerazioni |
screening di massa |
Mai, ad eccezione di marcatori strettamente tessuto- specifici in popolazioni a rischio (es.: PSA per prostata). |
diagnosi differenziale di neoplasia |
Come indagine di supporto in caso di dubbio alla presentazione diagnostica usando markers tessuto-specifici. |
caratterizzazione clinica della malattia |
A diagnosi conclusa possono fornire indicazioni di tipo prognostico in quanto i livelli ematici riflettono generalmente la massa tumorale. |
prima di terapia radicale |
Utile come valore basale. |
dopo intervento chirurgico radicale |
Utile nel caso di valori basali preoperatori alterati. Livelli normali post-operatori possono indicare la radicalità dell'intervento; livelli che rimangono elevati segnalano presenza di malattia residua o metastasi occulte. |
dopo chemio-radioterapia |
Solo se la neoplasia non è misurabile e nel caso di valori basali elevati; la riduzione dei livelli ematici conferma l'efficacia terapeutica. |
follow-up in pazienti liberi da malattia |
Utile. Aumenti delle concentrazioni indicano ripresa di malattia, spesso anticipando i segni clinici o i dati strumentali |
metastasi di origine sconosciuta |
In casi selezionati; usando marcatori ad elevata specificità per un tipo di tessuto. |
Fonte: http://infmestre2anno.altervista.org/index_file/Oncologia/oncologia_testo.doc
Sito web da visitare: http://infmestre2anno.altervista.org
Autore del testo: L. Menegaldo-G.Poles
Il testo è di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente i loro testi per finalità illustrative e didattiche. Se siete gli autori del testo e siete interessati a richiedere la rimozione del testo o l'inserimento di altre informazioni inviateci un e-mail dopo le opportune verifiche soddisferemo la vostra richiesta nel più breve tempo possibile.
I riassunti , gli appunti i testi contenuti nel nostro sito sono messi a disposizione gratuitamente con finalità illustrative didattiche, scientifiche, a carattere sociale, civile e culturale a tutti i possibili interessati secondo il concetto del fair use e con l' obiettivo del rispetto della direttiva europea 2001/29/CE e dell' art. 70 della legge 633/1941 sul diritto d'autore
Le informazioni di medicina e salute contenute nel sito sono di natura generale ed a scopo puramente divulgativo e per questo motivo non possono sostituire in alcun caso il consiglio di un medico (ovvero un soggetto abilitato legalmente alla professione).
"Ciò che sappiamo è una goccia, ciò che ignoriamo un oceano!" Isaac Newton. Essendo impossibile tenere a mente l'enorme quantità di informazioni, l'importante è sapere dove ritrovare l'informazione quando questa serve. U. Eco
www.riassuntini.com dove ritrovare l'informazione quando questa serve